网址:http://m.1010jiajiao.com/timu3_id_74394[举报]
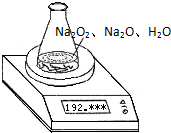 某种含有少量氧化钠的过氧化钠试样质量为1.56g,为测定各成分的质量分数,按如图所示,原锥形瓶和水的总质量为190.72,将1.56g上述样品投入锥形瓶中,充分反应后,电子天平最终的读数为192.12g.
某种含有少量氧化钠的过氧化钠试样质量为1.56g,为测定各成分的质量分数,按如图所示,原锥形瓶和水的总质量为190.72,将1.56g上述样品投入锥形瓶中,充分反应后,电子天平最终的读数为192.12g.求:
(1)反应中产生的氧气在标准状态下的体积为多少mL?
(2)样品中Na2O和Na2O2的物质的量比为多少?
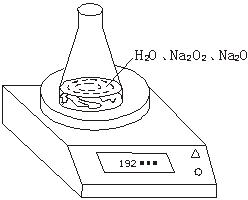
| 读数次数 | 质量(g) |
锥形瓶+水+试样 | 第1次 | 192.214 |
第2次 | 192.164 | |
第3次 | 192.028 | |
第4次 | 192.010 | |
第5次 | 192.010 |
(1)写出Na2O2和H2O反应的化学方程式_____________________________________。
(2)计算过氧化钠质量分数时,必需的数据是___________________________________,不必作第6次读数的原因是_________________________________________。
(3)测定上述样品(1.560 g)中Na2O2质量分数的另一种方案,其操作流程如下:
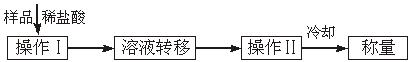
①操作Ⅱ的名称是______________。
②需直接测定的物理量是______________。
③测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要______________、______________(固定、夹持仪器除外)。
④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果______________(填“偏大”“偏小”或“不变”)。

| 读数次数 | 质量(g) |
锥形瓶+水+试样 | 第一次 | 192.214 |
第二次 | 192.164 | |
第三次 | 192.028 | |
第四次 | 192.010 | |
第五次 | 192.010 |
(1)写出Na2O2和H2O反应的化学方程式 。
(2)计算过氧化钠的质量分数时,必需的数据是 ,不必作第六次读数的原因是 。
(3)测定上述样品(
![]()
①操作Ⅱ的名称是 。
②需直接测定的物理量是 。
③测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要 、 (固定、夹持仪器除外)。
④在转移溶液时,如溶液转移不完全,则Na2O2的质量分数的测定结果 (填“偏大”“偏小”或“不变”)。
| 读数次数 | 质量/g |
锥形瓶+水+试样 | 第1次 | 192.214 |
第2次 | 192.164 | |
第3次 | 192.028 | |
第4次 | 192.010 | |
第5次 | 192.010 |
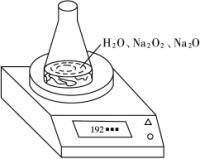
(1)写出Na2O2和H2O反应的化学方程式________________________________。
(2)计算过氧化钠质量分数时,必需的数据是________________。不必作第6次读数的原因是________________________________。
(3)测定上述样品(1.560 g)中Na2O2质量分数的另一种方案,其操作流程如下:
样品↓稀盐酸
![]()
①操作Ⅱ的名称是____________。
②需直接测定的物理量是____________。
③测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要________、________(固定、夹持仪器除外)。
④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果____________(填“偏大”“偏小”或“不变”)。
查看习题详情和答案>>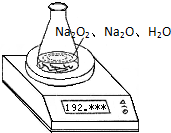 某种含有少量氧化钠的过氧化钠试样质量为1.56g,为测定各成分的质量分数,按如图所示,原锥形瓶和水的总质量为190.72,将1.56g上述样品投入锥形瓶中,充分反应后,电子天平最终的读数为192.12g.
某种含有少量氧化钠的过氧化钠试样质量为1.56g,为测定各成分的质量分数,按如图所示,原锥形瓶和水的总质量为190.72,将1.56g上述样品投入锥形瓶中,充分反应后,电子天平最终的读数为192.12g.