网址:http://m.1010jiajiao.com/timu3_id_74081[举报]
 (2011?湖南二模)[化学一选修化学与技术]
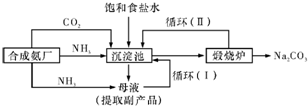
(2011?湖南二模)[化学一选修化学与技术]纯碱(Na2CO3)在工业生产和生活中有重要应用,其实验室制法和工业制法如下:
【实验室制备纯碱】
(1)将饱和NaCl溶液倒入烧杯中加热,控制温度为30?350C
(2)搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟
(3)静置、过滤得NaHCO3晶体
(4)用少量蒸馏水洗涤、抽干
(5)将所得固体转人蒸发皿中灼烧得Na2CO3固体
问题:①反应将温度需控制在30?35曟,通常采取的加热方法为
②静置后只析出NaHCO3晶体的原因是
【工业制备纯碱】
③沉淀池中反应的离子方程式为
④循环(I)、循环(II)中物质的化学式分别为
2NaHCO3
| ||
2NaHCO3
| ||
(1)在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是
(2)用该方法获得的Na2S2O3.H2O晶体中常混有一定量的杂质.某兴趣小组欲对其中所含杂质成分进行探究(不考虑副反应和杂质所带的结晶水).
[提出假设]
假设1:晶体中只含Na2CO3杂质
假设2:晶体中只含Na2S杂质
假设3:
[查阅资料]
①SO2+2H2S═3S↓+2H2O
②Na2S2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应:
Na2S2O3+H2SO4═Na2SO4+S↑+SO2↑+H2O
③CuSO4+H2S=CuS↓(黑色)+H2SO4
[判断与思考]
某同学取少量制得的晶体溶于足量稀H2SO4,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立.你认为其结论是否合理?
[设计方案进行实验]
基于假设1,完成下表实验方案、现象及结论(仪器自选).
限选实验试剂:3mol?L-1H2SO4、1mol?L-1NaOH、酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
| 实验方案 | 现象及结论 |
用0.010mol?L-1的碘水进行多次取样滴定,测得Na2S2O3?5H2O的含量约为102%.若所用试剂及操作均无不当,产生该结果最可能的原因是
(8分)(1)已知20oC时的溶解度:Na2CO3:S=21.2g; NaHCO3:S=9.6g。则20oC恒温条件下向121.2g饱和碳酸钠溶液中通入足量的CO2气体,理论上可以析出NaHCO3__________g(小数点后保留1位)
(2)向500mL KOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。若通入CO2气体为2.24L(标准状况下),得到11.9g的白色固体。则所用的KOH溶液的物质的量浓度为______mol/L。
(3)将一定质量的钠加入到89g水中,完全反应后的溶液为100g,则该溶液的质量分数为________。
(4)现有甲、乙两瓶无色溶液,已知它们可能是AlCl3溶液和NaOH溶液.现做如下实验:
①取440ml甲与120ml乙反应,产生1.56g沉淀;
②取440ml乙与120ml甲反应,也产生1.56g沉淀;
③取120ml甲溶液与400ml乙溶液反应,则产生3.12g沉淀;通过必要的计算和推理判定:
甲溶液为 溶液,乙溶液为 溶液。
(8分)(1)已知20oC时的溶解度:Na2CO3:S=21.2g; NaHCO3:S=9.6g。则20oC恒温条件下向121.2g饱和碳酸钠溶液中通入足量的CO2气体,理论上可以析出NaHCO3__________g(小数点后保留1位)
(2)向500mL KOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。若通入CO2气体为2.24L(标准状况下),得到11.9g的白色固体。则所用的KOH溶液的物质的量浓度为______mol/L。
(3)将一定质量的钠加入到89g水中,完全反应后的溶液为100g,则该溶液的质量分数为________。
(4)现有甲、乙两瓶无色溶液,已知它们可能是AlCl3溶液和NaOH溶液.现做如下实验:
①取440ml甲与120ml乙反应,产生1.56g沉淀;
②取440ml乙与120ml甲反应,也产生1.56g沉淀;
③取120ml甲溶液与400ml乙溶液反应,则产生3.12g沉淀;通过必要的计算和推理判定:
甲溶液为 溶液,乙溶液为 溶液。
查看习题详情和答案>>