摘要:1182.现有2.8g碱金属(R)及其氧化物(R2O)组成的混合物与足量水反应形成3.58g碱.则该金属为 A.Na B.K C.Li D.Rb
网址:http://m.1010jiajiao.com/timu3_id_73709[举报]
铁氧体是一类磁性材料,通式为MO?xFe2O3(M为二价金属离子),如Fe3O4可表示为FeO?Fe2O3,制备流程为:
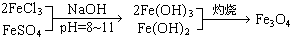
根据题意回答问题:
(1)现称取2.8g铁粉,加入一定量的稀硫酸使其完全溶解后,再加入______g的FeCl3固体,经上述反应后,方可得到纯净的Fe3O4.
(2)如果以MgSO4和FeCl3为原料,要获得18.0克MgO?2Fe2O3,在制取过程中至少需要1mol/L的NaOH溶液______mL.
(3)在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品.取一定量该产品溶于足量盐酸中,还需通入标准状况下672mLCl2才能把溶液中的Fe2+全部氧化为Fe3+,然后把所得溶液蒸干,灼烧至恒重,得9.6g固体.该产品的化学式为______.
(4)有一种在电子工业上应用广泛的含铬铁氧体,其组成可表示为:Fe2+?Fe3+[Fe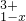 ?
?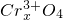 ],现有15.2g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为______.
],现有15.2g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为______.
查看习题详情和答案>>
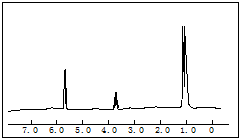 5.8g某含氧衍生物在足量的氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重5.4g,氢氧化钠溶液增重13.2g.对该物质进行质谱分析,在所得的质谱图中有质荷比分别的27、29、31、44、50、58六条谱线,图是该物质的核磁共振氢谱,并且峰面积比分别为1:1:6,根据上述信息,完成下列问题:
5.8g某含氧衍生物在足量的氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重5.4g,氢氧化钠溶液增重13.2g.对该物质进行质谱分析,在所得的质谱图中有质荷比分别的27、29、31、44、50、58六条谱线,图是该物质的核磁共振氢谱,并且峰面积比分别为1:1:6,根据上述信息,完成下列问题:(1)确定该物质的分子式;
(2)推测其结构,写出该物质的结构简式并命名.
兰州近代物理研究所研制出我国首批氧-18气体.氧-18是氧的一种同位素,称为重氧,下列说法正确的是( )
| A、1.8g氧-18气体的物质的量是0.1mol | B、0.1mol重氧气体的体积是2.24L | C、重氧气体的摩尔质量为36g | D、0.1mol重氧水所含中子数约是6.02×1023个 |