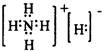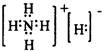摘要:①往溶液中逐滴滴入盐酸.先无气体放出.后有气体生成.发生的反应的离子方程式依次为: . . ②往.溶液中逐滴滴入.盐酸放出标况下气体A,往.盐酸溶液中逐滴滴入.放出标况下气体B.则:A∶B= ∶ .
网址:http://m.1010jiajiao.com/timu3_id_73658[举报]
I、亚铁是血红蛋白的重要组成成分,起着向人体组织传送O2的作用,人如果缺铁就可能出现缺铁性贫血,但是摄入过量的铁也有害。下面是一种补铁药品说明书中的部分内容:该药品为无水碱式盐,含
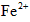 34%~36%,是糖衣片,……,与
34%~36%,是糖衣片,……,与 (维生素C)同服可增加本品吸收。某同学设计实验时对其中的铁成分进行了验证。请完成该实验:
(维生素C)同服可增加本品吸收。某同学设计实验时对其中的铁成分进行了验证。请完成该实验:
(1)第一步:查阅资料得知,双氧水可以氧化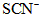 生成
生成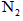 、
、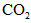 和SO42-,也可以将
和SO42-,也可以将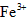 氧化成
氧化成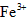 。
。
(2)第二步:向去掉糖衣、研磨好的药品中加稀盐酸,出现淡绿色浑浊液,说明有Fe2+离子存在;
(3)第三步:往上述溶液中滴入几滴KSCN溶液,出现浅红色,说明溶液中有少量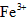 离子存在。该离子存在的原因可能是(填序号):___________________
离子存在。该离子存在的原因可能是(填序号):___________________
①药品中的铁本来就是以三价铁的形式存在;
②在制药过程中生成少量三价铁;
③本实验过程中有少量三价铁生成。
(4)第四步:将第三步所得溶液分成2份,分别装在A、B两个试管中。
(5)第五步:向A试管的溶液中加入少量稀硫酸,再慢慢滴入过量的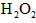 溶液,溶液的红色先变深,之后红色逐渐褪去。
溶液,溶液的红色先变深,之后红色逐渐褪去。
①红色变深的原因是(用离子方程式表示):__________________________;
②请自选中学实验室中常用仪器、药品,设计实验证明溶液红色褪去的原因:____________________。
(6)第六步:向B试管的溶液中加入一片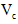 片,片刻后溶液红色也褪去,说明
片,片刻后溶液红色也褪去,说明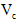 有___________性。
有___________性。
II、以石墨为电极,电解法处理黄铜矿(CuFeS2)精矿,可以制得硫酸铜溶液和单质硫。黄铜矿在阳极的浸出反应比较复杂,主要有:CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S,CuFeS2+4Fe3+=Cu2++5Fe2++2S, 2Fe3+ + H2S = 2H+ + S↓ + 2Fe2+。下图为该工艺的示意图。
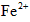 34%~36%,是糖衣片,……,与
34%~36%,是糖衣片,……,与 (维生素C)同服可增加本品吸收。某同学设计实验时对其中的铁成分进行了验证。请完成该实验:
(维生素C)同服可增加本品吸收。某同学设计实验时对其中的铁成分进行了验证。请完成该实验:(1)第一步:查阅资料得知,双氧水可以氧化
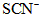 生成
生成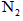 、
、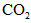 和SO42-,也可以将
和SO42-,也可以将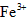 氧化成
氧化成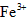 。
。(2)第二步:向去掉糖衣、研磨好的药品中加稀盐酸,出现淡绿色浑浊液,说明有Fe2+离子存在;
(3)第三步:往上述溶液中滴入几滴KSCN溶液,出现浅红色,说明溶液中有少量
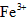 离子存在。该离子存在的原因可能是(填序号):___________________
离子存在。该离子存在的原因可能是(填序号):___________________ ①药品中的铁本来就是以三价铁的形式存在;
②在制药过程中生成少量三价铁;
③本实验过程中有少量三价铁生成。
(4)第四步:将第三步所得溶液分成2份,分别装在A、B两个试管中。
(5)第五步:向A试管的溶液中加入少量稀硫酸,再慢慢滴入过量的
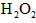 溶液,溶液的红色先变深,之后红色逐渐褪去。
溶液,溶液的红色先变深,之后红色逐渐褪去。 ①红色变深的原因是(用离子方程式表示):__________________________;
②请自选中学实验室中常用仪器、药品,设计实验证明溶液红色褪去的原因:____________________。
(6)第六步:向B试管的溶液中加入一片
 片,片刻后溶液红色也褪去,说明
片,片刻后溶液红色也褪去,说明 有___________性。
有___________性。II、以石墨为电极,电解法处理黄铜矿(CuFeS2)精矿,可以制得硫酸铜溶液和单质硫。黄铜矿在阳极的浸出反应比较复杂,主要有:CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S,CuFeS2+4Fe3+=Cu2++5Fe2++2S, 2Fe3+ + H2S = 2H+ + S↓ + 2Fe2+。下图为该工艺的示意图。
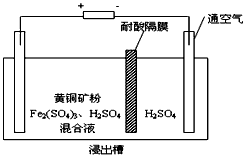
(1)电解过程实现了Fe3+的循环,则阳极方程式为___________________ 。
(2)电解过程中阴极有金属析出,向阴极通空气的原因是________________________。
(3)与燃烧法炼铜相比,电解法的优点为________________________。
查看习题详情和答案>>
(2)电解过程中阴极有金属析出,向阴极通空气的原因是________________________。
(3)与燃烧法炼铜相比,电解法的优点为________________________。
(2013?金华模拟)某物质M具有热导率高、高温下电绝缘性好、高温下材料强度大、无毒等优异性能.经检测,M中只含有两种短周期元素.现取82gM溶于适量的NaOH溶液中恰好反应,得到无色溶液A和44.8L气体B(气体体积为标准状况下),该气体能使红色石蕊试纸变蓝.往反应后的溶液中逐滴加入盐酸,可观察到溶液先变浑浊后变澄清.
物质B有如下转化关系:B
C
D
EE是一种强酸.将c和D的混合物溶解在接近零度的水中,即可得到一种弱酸F的水溶液.请回答下列问题:
(1)物质M的化学式为
(2)无色溶液A呈碱性,其原因是
(3)弱酸F是一种比醋酸酸性稍强的弱酸,很不稳定,通常在室温下易分解.要制得F溶液,可以往冷冻的其钠盐浓溶液中加入或通入某种物质,下列物质不适合使用的是
a.盐酸 b.二氧化碳 c.稀硫酸 d.二氧化硫
(4)工业碱性废水中若含有NO-2,可用铝粉除去.已知此反应体系中检测到B气体.写出上述反应的离子方程式
(5)现发现一种活性很强的化合物G,其组成为NH5,G遇水能产生两种气体,其中一种气体为B,则物质G的电子式为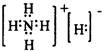
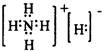 .
.
查看习题详情和答案>>
物质B有如下转化关系:B
| X |
| X |
| H2O |
(1)物质M的化学式为
AlN
AlN
,属于原子
原子
晶体(填“分子”、“离子”、“原子”等).(2)无色溶液A呈碱性,其原因是
AlO2-+2H2O=Al(OH)3+OH-
AlO2-+2H2O=Al(OH)3+OH-
(用离子方程式表示).(3)弱酸F是一种比醋酸酸性稍强的弱酸,很不稳定,通常在室温下易分解.要制得F溶液,可以往冷冻的其钠盐浓溶液中加入或通入某种物质,下列物质不适合使用的是
bd
bd
(填序号).a.盐酸 b.二氧化碳 c.稀硫酸 d.二氧化硫
(4)工业碱性废水中若含有NO-2,可用铝粉除去.已知此反应体系中检测到B气体.写出上述反应的离子方程式
2Al+NO2-+OH-+H2O=2AlO2-+NH3↑
2Al+NO2-+OH-+H2O=2AlO2-+NH3↑
.若改用电解法将废水中NO-2转换为N2除去,N2将在阴极
阴极
(填“阴极”或“阳极”)生成,电极反应为2NO2-+6e-+4H2O=N2+8OH-
2NO2-+6e-+4H2O=N2+8OH-
.(5)现发现一种活性很强的化合物G,其组成为NH5,G遇水能产生两种气体,其中一种气体为B,则物质G的电子式为