网址:http://m.1010jiajiao.com/timu3_id_73349[举报]
(2)含0.4 mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是________。
(3)已知16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D,则C的摩尔质量为_______。
(4)2.3 g Na中含________mol e-,在跟足量水反应中失去________mol e-。
(5)如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(设NA为阿伏加德罗常数)______________。
(1)0.3 mol NH3分子中所含氢原子数与________个H2O分子中所含氢原子数相等。
(2)含0.4 mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是________(不考虑Al3+水解)。
(3)已知16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D,则C的摩尔质量为______。
(4)2.3 g Na中含______mol e-,在跟足量水反应中失去__________mol e-。
查看习题详情和答案>>计算:
Ⅰ、(1)0.3 mol NH3分子中所含氢原子数与_______NA个H2O分子中所含氢原子数相等。
(2)在标准状况下36 克CO和CO2的混合气体的体积为22.4L,则此混合气体中CO物质的量为 ;CO2的质量为 g 。
(3)将标准状况下224 L HCl气体溶于635 mL水中(ρ=1 g/cm3),所得盐酸的密度为1.18 g/cm3。则此盐酸的物质的量浓度为 。
(结果保留至小数点后1位)
Ⅱ、某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。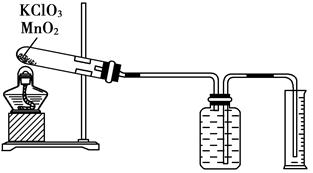
(1)实验步骤如下:
①连接好实验装置,检查装置的气密性。
②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g。
③加热,开始反应,直到不再有气体产生为止。
④测量排入量筒中水的体积为285.0 mL,换算成T℃,101kPa氧气的体积为360.0 mL。
⑤准确称量试管和残留物的质量为15.55 g。
(2)利用以上数据,本实验测得T℃,101kPa的气体摩尔体积为
(结果保留至小数点后1位)
计算:
Ⅰ、(1)0.3 mol NH3分子中所含氢原子数与_______NA个H2O分子中所含氢原子数相等。
(2)在标准状况下36 克CO和CO2的混合气体的体积为22.4L,则此混合气体中CO物质的量为 ;CO2的质量为 g 。
(3)将标准状况下224 L HCl气体溶于635 mL水中(ρ=1 g/cm3),所得盐酸的密度为1.18 g/cm3。则此盐酸的物质的量浓度为 。
(结果保留至小数点后1位)
Ⅱ、某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。

(1)实验步骤如下:
①连接好实验装置,检查装置的气密性。
②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g。
③加热,开始反应,直到不再有气体产生为止。
④测量排入量筒中水的体积为285.0 mL,换算成T℃,101kPa氧气的体积为360.0 mL。
⑤准确称量试管和残留物的质量为15.55 g。
(2)利用以上数据,本实验测得T℃,101kPa的气体摩尔体积为
(结果保留至小数点后1位)
查看习题详情和答案>>
计算:
Ⅰ、(1)0.3 mol NH3分子中所含氢原子数与_______NA个H2O分子中所含氢原子数相等。
(2)在标准状况下36 克CO和CO2的混合气体的体积为22.4L,则此混合气体中CO物质的量为 ;CO2的质量为 g 。
(3)将标准状况下224 L HCl气体溶于635 mL水中(ρ=1 g/cm3),所得盐酸的密度为1.18 g/cm3。则此盐酸的物质的量浓度为 。
(结果保留至小数点后1位)
Ⅱ、某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。

(1)实验步骤如下:
①连接好实验装置,检查装置的气密性。ks5u
②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g。
③加热,开始反应,直到不再有气体产生为止。
④测量排入量筒中水的体积为285.0 mL,换算成T℃,1O1kPa氧气的体积为360.0 mL。
⑤准确称量试管和残留物的质量为15.55 g。
(2)利用以上数据,本实验测得T℃,1O1kPa的气体摩尔体积为 。
(结果保留至小数点后1位)
查看习题详情和答案>>