摘要:17.A.B.C.D.E是原子序数依次增大的五种短周期元素.A原子的电子层数与它的核外电子总数相同.A与C.B与D分别为同主族.B和C的最外层电子数之和与E的最外层电子数相同.A与E形成的化合物化学式为AE.其分子中含18个电子.请回答下列问题: (1)A元素单质的化学式为 .D元素的原子结构示意图为 . (2)由A.B.C三种元素形成的化合物的电子式为 .这种化合物中所含的化学键类型有 . (3)A2B的沸点高于A2D.其原因是 . (4)B.C.E三种元素形成一种盐.此盐中三种原子个数比为1?1?1.在25℃时.将该盐溶于水.测得溶液pH>7.理由是 ,将该盐溶液在空气中露置一段时间后(充分光照.不考虑水分的挥发).溶液的pH近似为7.则该过程的总反应方程式为 . 解析:由AE分子中含18个e-.可知A为H.E为Cl.A.C同主族.B和C的最外层电子数之和与E的最外层电子数相同.则B的最外层电子数为6.为O.D为S.则C为Na. (3)H2O中因含有氢键.其沸点高于H2S. (3)H2O分子之间存在氢键 (4)ClO-+H2OHClO+OH- 2NaClO2NaCl+O2↑
网址:http://m.1010jiajiao.com/timu3_id_72758[举报]
A、B、C、D、E是常见化合物或单质,有如下转化关系(略去条件和副产品).

(1)若D为氧气,C为NaAlO2,试写出B转化为C的化学方程式
(2)若A为气态单质,B为漂白粉的有效成份,C具有漂白性.试写A转化为B的化学方程式
(3)若A、B、C均为钠盐的水溶液,D、E均为卤素单质,请写出B转化为C的离子方程式
(4)若A常温下为固态单质,化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,且D、E为同一物质,则B为
(5)若B、D为质子数小于18的元素原子形成的单质,A、E、C均为氧化物,且D所含元素原子的质子数是B的2倍,A转化为B,B转化为C两个反应均属置换反应,请写出A转化为B的化学方程式
查看习题详情和答案>>

(1)若D为氧气,C为NaAlO2,试写出B转化为C的化学方程式
Al2O3+2NaOH=2NaAlO2+H2O
Al2O3+2NaOH=2NaAlO2+H2O
.(2)若A为气态单质,B为漂白粉的有效成份,C具有漂白性.试写A转化为B的化学方程式
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
.画出组成单质A的元素原子结构示意图.(3)若A、B、C均为钠盐的水溶液,D、E均为卤素单质,请写出B转化为C的离子方程式
2Br-+Cl2=Br2+2Cl-
2Br-+Cl2=Br2+2Cl-
.(4)若A常温下为固态单质,化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,且D、E为同一物质,则B为
SO2
SO2
.(5)若B、D为质子数小于18的元素原子形成的单质,A、E、C均为氧化物,且D所含元素原子的质子数是B的2倍,A转化为B,B转化为C两个反应均属置换反应,请写出A转化为B的化学方程式
2Mg+CO2
2MgO+C
| ||
2Mg+CO2
2MgO+C
.
| ||
A、B、C、D、E是原子序数依次增大的五种短周期元素.A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同.A与E形成的化合物化学式为AE,其分子中含18个电子.请回答下列问题:
(1)A元素单质的化学式为 ,D元素的原子结构示意图为 .
(2)由A、B、C三种元素形成的化合物的电子式为 ,这种化合物形成的晶体中所含的化学键类型有 .
(3)A、B、D三种元素形成的一种化合物和A、B形成的一种化合物能发生氧化还原反应,反应的化学方程式为 .
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1:1:1,在25℃时,将该盐溶于水,测得溶液的pH>7,理由是 (用离子方程式表示).
查看习题详情和答案>>
(1)A元素单质的化学式为
(2)由A、B、C三种元素形成的化合物的电子式为
(3)A、B、D三种元素形成的一种化合物和A、B形成的一种化合物能发生氧化还原反应,反应的化学方程式为
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1:1:1,在25℃时,将该盐溶于水,测得溶液的pH>7,理由是
已知A、B、C、D、E是含有一种相同元素的五种物质,他们之间可发生转化: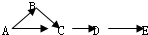 其中A是单质,B是气体,C、D是氧化物,E是最高价氧化物对应的水化物.
其中A是单质,B是气体,C、D是氧化物,E是最高价氧化物对应的水化物.
(1)如果A是一种淡黄色粉末固体,这五种物质的化学式分别是:
A
(2)如果A是一种常见的气体,这五种物质的化学式分别是:
A
查看习题详情和答案>>
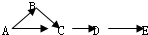 其中A是单质,B是气体,C、D是氧化物,E是最高价氧化物对应的水化物.
其中A是单质,B是气体,C、D是氧化物,E是最高价氧化物对应的水化物.(1)如果A是一种淡黄色粉末固体,这五种物质的化学式分别是:
A
S
S
,BH2S
H2S
; CSO2
SO2
; DSO3
SO3
;EH2SO4
H2SO4
.(2)如果A是一种常见的气体,这五种物质的化学式分别是:
A
N2
N2
,BNH3
NH3
; CNO
NO
; DNO2
NO2
;EHNO3
HNO3
.A、B、C、D、E是相邻的三个周期中的五种短周期元素,它们的原子序数依次增大,B、C、D属于同一周期,A、E属于同一主族.已知:①除A外,各元素原子的内层均已填满电子,其中B的最外层有4个电子;②A与B,B与C 都能生成气态化合物;③D与E生成离子化合物,其离子的电子层结构相同.回答
(1)A为
(2)D在周期表中属于第
 .
.
(3)B与C可形成BC2的化合物的电子式为:
 ,属于
,属于
(4)C与E反应条件不同产物不同,请写出不同条件下不同产物的对应化学方程式①
查看习题详情和答案>>
(1)A为
H
H
(填元素符号,下同); C为O
O
;(2)D在周期表中属于第
二
二
周期,第VIIA
第VIIA
族元素,其原子结构示意图为

(3)B与C可形成BC2的化合物的电子式为:


共价
共价
化合物(填共价或离子)(4)C与E反应条件不同产物不同,请写出不同条件下不同产物的对应化学方程式①
4Na+O2=2Na2O
4Na+O2=2Na2O
;②2Na+O2
Na2O2
| ||
2Na+O2
Na2O2
.
| ||