摘要:下表是元素周期表的一部分.已知元素⑤⑥⑦均可构成电子数为18的微粒. ① ② ③ ④ ⑤ ⑥ ⑦ (1)某元素能形成的化合物种类最多.该元素是 .该元素有多种同位素.在科学上均有重要的应用.写出其中任意一种同位素的某一项用途- . (2)⑤号元素可形成两种18电子的阴离子.其离子符号分别为 . . (3)①~⑥号六种元素的简单氢化物中.沸点最高的是- . (4)①~⑦号七种元素中.原子半径最小的元素具有的性质是 . A.单质可与水反应.形成两种化合物 B.单质可与⑥的钠盐溶液反应.置换出元素⑥的单质 C.气态氢化物的水溶液呈弱酸性 D.可以用玻璃器皿在实验室制取该元素的气态氢化物
网址:http://m.1010jiajiao.com/timu3_id_72310[举报]
下表是元素周期表的一部分,A、B、C、D、E、X是下表中给出元素组成的常见单质或化合物.

已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)

(1)若E为单质气体,D为白色沉淀,A的化学式可能是
(2)若E为氧化物,则A与水反应的化学方程式为
①当X是碱性盐溶液,C分子中有22个电子时,则C的结构式为
②当X为金属单质时,X与B的稀溶液反应生成C的离子方程式为
(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,写出该可逆反应的化学方程式
查看习题详情和答案>>

已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)

(1)若E为单质气体,D为白色沉淀,A的化学式可能是
Na、Na2O2
Na、Na2O2
,C与X反应的离子方程式为3AlO2-+Al3++6H2O═4Al(OH)3↓
3AlO2-+Al3++6H2O═4Al(OH)3↓
.(2)若E为氧化物,则A与水反应的化学方程式为
3NO2+H2O═2HNO3+NO
3NO2+H2O═2HNO3+NO
.①当X是碱性盐溶液,C分子中有22个电子时,则C的结构式为
O=C=O
O=C=O
,表示X呈碱性的离子方程式为CO32-+H2O?HCO3-+OH-,
CO32-+H2O?HCO3-+OH-,
.②当X为金属单质时,X与B的稀溶液反应生成C的离子方程式为
3Fe+8H++2NO3-═2Fe3++2NO↑+4H2O
3Fe+8H++2NO3-═2Fe3++2NO↑+4H2O
.(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,写出该可逆反应的化学方程式
CO+H2O
CO2+H2
| 高温 |
CO+H2O
CO2+H2
.t℃时,在密闭恒容的某容器中投入等物质的量的D和水蒸气,一段时间后达到平衡,该温度下反应的平衡常数K=1,D的转化率为| 高温 |
50%
50%
. 下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.| a | b | ||||||||||||||||
| c | d | ||||||||||||||||
| e | f | g | h | i | |||||||||||||
| j | |||||||||||||||||
[Ar]3d74s2
[Ar]3d74s2
.(2)c、d原子半径大小c
>
>
d,第一电离能大小关系是c>
>
d,电负性大小关系是c<
<
d.(以上填“>”或“<”)(3)已知NH3?H2O的电离方程式为NH3?H2O?NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
(b)
(b)
(填序号,见图).(4)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
①原子核对核外电子的吸引力②形成稳定结构的倾向
下表是一些主族元素的气态原子失去核外不同电子所需的能量(kJ?mol-):
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
Mg
Mg
、Al
Al
(填写元素符号).下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.

(1)请写出元素d的基态原子电子排布式 .
(2)b元素的氧化物中b与氧元素之间的共价键类型是 .其中b原子的杂化方式是 .
(3)a单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示.

若已知a的原子半径为d,NA代表阿伏加德罗常数,a的相对原子质量为M,则一个晶胞中a原子的数目为 ,该晶体的密度为 (用字母表示).
查看习题详情和答案>>

(1)请写出元素d的基态原子电子排布式
(2)b元素的氧化物中b与氧元素之间的共价键类型是
(3)a单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示.

若已知a的原子半径为d,NA代表阿伏加德罗常数,a的相对原子质量为M,则一个晶胞中a原子的数目为
下表是元素周期表的一部分,元素①~⑨在表中的位置如图所示.
用化学用语回答有关问题(除(5)Ⅰ外):
(1)②、⑧、⑨的最高价氧化物的水化物酸性由弱到强的顺序是 ;
(2)⑤、⑥、⑧的简单离子的半径由大到小的顺序是 ;
(3)写出由其中两种元素组成的既含离子键又含共价键的化合物的电子式 ;
(4)由①、②组成的最简单有机物可与空气组成以氢氧化钾为电解质的燃料电池.写出该燃料电池工作时的总反应方程式 ,负极离子反应式为 .
(5)由⑦、⑨组成的化合物A和由①、③组成的化合物B按物质的量之比为1:4在一定条件下进行反应,并按如图所示转化,最终可得到一种新型无机非金属材料E,E是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击落、抗氧化等特性一.F是一种白色沉淀.
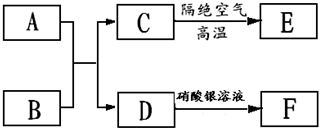
I.E的晶体类型为 ;
II.已知A与水的反应属于水解反应,写出其反应的化学方程式 ;
III.又知A与过量B的反应类似于完全的水解反应,则C的化学式为 .
查看习题详情和答案>>
| IA | 0 | |||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)②、⑧、⑨的最高价氧化物的水化物酸性由弱到强的顺序是
(2)⑤、⑥、⑧的简单离子的半径由大到小的顺序是
(3)写出由其中两种元素组成的既含离子键又含共价键的化合物的电子式
(4)由①、②组成的最简单有机物可与空气组成以氢氧化钾为电解质的燃料电池.写出该燃料电池工作时的总反应方程式
(5)由⑦、⑨组成的化合物A和由①、③组成的化合物B按物质的量之比为1:4在一定条件下进行反应,并按如图所示转化,最终可得到一种新型无机非金属材料E,E是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击落、抗氧化等特性一.F是一种白色沉淀.

I.E的晶体类型为
II.已知A与水的反应属于水解反应,写出其反应的化学方程式
III.又知A与过量B的反应类似于完全的水解反应,则C的化学式为
下表是元素周期表的一部分,表中字母分别代表某一化学元素,请回答有关问题。
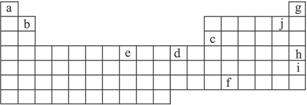
(1)人们曾认为g、h、i不发生化学反应,因而把它们叫做稀有气体,但是后来发现这族气体可以参加化学反应,你认为g、h、i中最有可能首先被发现可以参加化学反应的元素是_______________,其原因是_______________________________________________________。
(2)e是周期表中的_____________族元素,最外层电子数为_____________。
(3)a的阴离子半径_____________b的阳离子半径(填“大于”“等于”或“小于”)。
(4)在元素周期表中有一个对角线规则,其中包括b、c的化合物的性质十分相似。则b的氯化物与少量和过量的氢氧化钠溶液发生反应的离子方程式分别为(要表达出具体的元素符号,下同)__________________________________;______________________________。
(5)f的+4价氧化物可与浓盐酸反应,且已知其氧化性强于氯气,则该氧化物与浓盐酸反应的化学方程式可表示为____________________________________________________。
查看习题详情和答案>>