摘要:13.超细氧化加NaOH溶液是一种重要的功能陶瓷原料. (1)实验室常以NH4Al(SO4)2和NH4HCO3为原料.在一定条件下先反应生成沉淀NH4AlO(OH)HCO3.该沉淀高温分解即得超细Al2O3.NH4AlO(OH)HCO3热分解的化学反应方程式为 . (2)NH4Al(SO4)2·12H2O的相对分子质量为453.欲配制100 mL pH为2.浓度约为0.1 mol/L的NH4Al(SO4)2溶液.配制过程为: ①用托盘天平称量NH4Al(SO4)2·12H2O固体 g, ②将上述固体置于烧杯中. . (3)在0.1 mol/L NH4Al(SO4)2溶液中.加NaOH溶液各形态的浓度(以Al3+计)的对数(lgc)随溶液pH变化的关系见下图: ①用NaOH溶液调节(2)中溶液pH至7.该过程中发生反应的离子方程式有 . ②请画出0.01 mol/L NH4Al(SO4)2溶液中加NaOH溶液各形态的浓度的对数lgc随溶液pH变化的关系图.并进行必要的标注. 解析 (1)根据题中信息及元素守恒NH4AlO(OH)HCO3热分解的产物除Al2O3外还应有NH3.H2O和CO2:2NH4AlO(OH)HCO3Al2O3+2NH3↑+3H2O+2CO2↑. (2)①n[NH4Al(SO4)2]=0.1 L×0.1 mol/L=0.01 mol m[NH4Al(SO4)2·12H2O]=0.01 mol×453 g/mol=4.53 g≈4.5 g 称量→称量→溶解→移液→洗涤→定容. (3)①从图中可看出pH=7时.Al元素全部以Al(OH)3形式存在. ②依据题中给出的0.1 mol/L NH4Al(SO4)2的图象.可画出0.01 mol/L的图象.同时标明加NaOH溶液元素的存在形态Al3+.Al(OH)3.AlO即可. 答案 (1)2NH4AlO(OH)HCO3Al2O3+2NH3↑+3H2O+2CO2↑ 移液→移液→洗涤→定容 (3)①Al3++3OH-===Al(OH)3↓. H++OH-===H2O. NH+OH-===NH3·H2O ②
网址:http://m.1010jiajiao.com/timu3_id_69582[举报]
某化学课外活动小组为了探究不同催化剂对氧化氢分解速率的影响,设计并进行了如下实验,请你完成下列各项任务。
I.氧化铜的制备。
(1)称取10g胆矾,将其放入小烧杯中,再溶于适量水配成溶液。
(2)向步骤(1)中的烧杯内滴加NaOH溶液,直至产生大量的沉淀。
(3)检验沉淀是否完全,其操作方法是 。
(4)将步骤(2)所得混合物加热至沉淀全部变为黑色。
(5)再将步骤(4)所得混合物 、洗涤、 后研细。本步骤中要验证是否洗净硫酸根离子的方法是: 。
II.比较不同催化剂对过氧化氢分解速率的影响。
该课外活动小组拟完成的实验及实验记录的表格如下,
拟采用下图所示装置来测定氧气的体积。

| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| ① | 15mL | 无 | |
| ② | 15mL | CuO(0.5g) | |
| ③ | 15mL | MnO2(0.5g) |
试回答下列问题:
(1)本实验中影响双氧水分解速率的因素有:①实验时的温度和压强;②双氧水的浓度
③不同的催化剂;④ ;⑤ 等。
(2)上述实验中的“待测数据”可以是 ;也可以是 。
(3)为探究CuO在实验②中是否起催化作用,除与①比较外,还需补做下列实验(不必写具体操作):①证明CuO的化学性质没有改变;② 。
(4)你认为可以使过氧化氢分解的催化剂还有 (填一种物质的化学式或名称)。
查看习题详情和答案>>(1)用滴管将新制的饱和氯水逐滴滴入含酚酞的氢氧化钠的稀溶液中,当滴到最后一滴时,红色突然褪去.产生该现象的原因可能有两个:
①是由于
用实验证明红色褪去的原因是①或者是②,其方法是:
(2)在一定条件下氯气可与氯化铵发生反应:xCl2+yNH4Cl→yNCln+(x+y)HCl,当消耗6.72L标准状况下的氯气时,生成0.10mol氮的氯化物,则此氮的氯化物的化学式为
查看习题详情和答案>>
①是由于
氯水中H+与碱中和
氯水中H+与碱中和
;②是由于氯水中HClO强氧化性所致
氯水中HClO强氧化性所致
.?用实验证明红色褪去的原因是①或者是②,其方法是:
向褪色溶液中再滴加NaOH溶液,若红色再现,则是①
向褪色溶液中再滴加NaOH溶液,若红色再现,则是①
若红色不再现,则是②.
若红色不再现,则是②.
.(2)在一定条件下氯气可与氯化铵发生反应:xCl2+yNH4Cl→yNCln+(x+y)HCl,当消耗6.72L标准状况下的氯气时,生成0.10mol氮的氯化物,则此氮的氯化物的化学式为
NCl3
NCl3
.Ⅰ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:
(1)在一定体积的恒容密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
其化学平衡常数K与温度t的关系如下表:
完成下列问题:
①比较K1、K2的大小:K1
②判断该反应达到化学平衡状态的依据是
A.2v(H2)(正)=3v(NH3)(逆) B.v(N2)(正)=3v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(2)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.
①写出盐酸肼第一步水解反应的离子方程式
②盐酸肼水溶液中离子浓度的排列顺序正确的是
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5?H2O+])>c(H+)>c(OH-)
C.c(N2H62+)+c([N2H5?H2O+])+c(H+)=c(Cl-)+c(OH-)
D.c(N2H62+)>c(Cl-)>c(H+)>c(OH-)
Ⅱ.水体中重金属铅的污染问题备受关注.查资料得知Pb4+具有很强的氧化性.水中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2(在水中溶解度小)、Pb(OH)3-、Pb(OH)42-,各形态的物质的量的分数α随溶液pH变化的关系如下图所示:
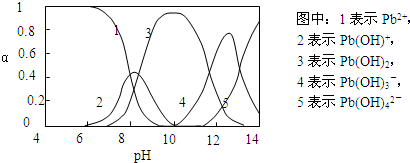
(1)Pb(NO3)2溶液中,c(Pb2+)/c(NO3-)
(2)向Pb(NO3)2溶液滴加盐酸,溶液中c(Pb2+)/c(NO3-)没有变大,反而变小并有沉淀生成,则生成的沉淀可能为
(3)向Pb(NO3)2溶液中滴加NaOH溶液,溶液也变浑浊,在pH约为
查看习题详情和答案>>
(1)在一定体积的恒容密闭容器中,进行如下化学反应:N2(g)+3H2(g)
 2NH3(g)
2NH3(g)其化学平衡常数K与温度t的关系如下表:
| t/K | 298 | 398 | 498 | … |
| K/(mol?L-1)2 | 4.1×106 | K1 | K2 | … |
①比较K1、K2的大小:K1
>
>
K2(填“>”、“=”或“<”).②判断该反应达到化学平衡状态的依据是
AC
AC
(填序号).A.2v(H2)(正)=3v(NH3)(逆) B.v(N2)(正)=3v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(2)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.
①写出盐酸肼第一步水解反应的离子方程式
N2H62++H2O [N2H5?H2O]++H+
[N2H5?H2O]++H+
 [N2H5?H2O]++H+
[N2H5?H2O]++H+N2H62++H2O [N2H5?H2O]++H+
[N2H5?H2O]++H+
. [N2H5?H2O]++H+
[N2H5?H2O]++H+②盐酸肼水溶液中离子浓度的排列顺序正确的是
A
A
(填序号).A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5?H2O+])>c(H+)>c(OH-)
C.c(N2H62+)+c([N2H5?H2O+])+c(H+)=c(Cl-)+c(OH-)
D.c(N2H62+)>c(Cl-)>c(H+)>c(OH-)
Ⅱ.水体中重金属铅的污染问题备受关注.查资料得知Pb4+具有很强的氧化性.水中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2(在水中溶解度小)、Pb(OH)3-、Pb(OH)42-,各形态的物质的量的分数α随溶液pH变化的关系如下图所示:

(1)Pb(NO3)2溶液中,c(Pb2+)/c(NO3-)
<
<
1/2(填“>”、“=”、“<”).(2)向Pb(NO3)2溶液滴加盐酸,溶液中c(Pb2+)/c(NO3-)没有变大,反而变小并有沉淀生成,则生成的沉淀可能为
PbCl2
PbCl2
.(3)向Pb(NO3)2溶液中滴加NaOH溶液,溶液也变浑浊,在pH约为
10
10
时生成沉淀最多,继续滴加NaOH溶液,混合体系又逐渐变澄清.pH=13时,混合体系中发生的主要反应的离子方程式为:Pb(OH)3-+OH-=Pb(OH)42-
Pb(OH)3-+OH-=Pb(OH)42-
.回答下列关于铁元素及其化合物的知识:
(1)除去铁粉中混有的铝粉可以选用的试剂为
A.稀盐酸 B,氢氧化钠溶液 C.浓硫酸 D.硝酸
需要进行的分离操作是
(2)向一支装有FeC3溶液的试管中滴加NaOH溶液,现象为
(3)为了检验某未知溶液是否含有Fe2+离子,两位同学分别设计了以下实验方案加以证明.
方案一:向一支装有该未知溶液的试管中先通入氯气,再滴加KSCN溶液,溶液呈现红色,证明该未知溶液含有Fe2+离子;
方案二:向另一支装有该未知溶液的试管中先滴加KSCN溶液,无现象,再通入氯气,溶液变为红色,证明该未知溶液含有Fe2+离子;
则请回答:①你认为哪个方案较为合理
②写出Fe2+与氯气反应的离子方程式
⑧实验室在保存含有Fe2+离子的溶液时,为了防止Fe2+离子变质,经常向其中加入铁粉,其原因是(用离子方程式表示)
(4)鲜榨苹果汁是人们喜爱的饮料.由于此饮料中含有Fe2+,鲜榨的苹果汁在空气中会由淡绿色的Fe2+变为棕黄色的Fe3+,则这个变色的过程中Fe2+被
A.氧化性 B.还原性 C.酸性 D.碱性.
查看习题详情和答案>>
(1)除去铁粉中混有的铝粉可以选用的试剂为
B
B
(填序号).A.稀盐酸 B,氢氧化钠溶液 C.浓硫酸 D.硝酸
需要进行的分离操作是
过滤
过滤
,涉及的主要的离子反应方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
;(2)向一支装有FeC3溶液的试管中滴加NaOH溶液,现象为
红褐色沉淀
红褐色沉淀
,其中含铁元素的产物的化学式是Fe(OH)3
Fe(OH)3
;(3)为了检验某未知溶液是否含有Fe2+离子,两位同学分别设计了以下实验方案加以证明.
方案一:向一支装有该未知溶液的试管中先通入氯气,再滴加KSCN溶液,溶液呈现红色,证明该未知溶液含有Fe2+离子;
方案二:向另一支装有该未知溶液的试管中先滴加KSCN溶液,无现象,再通入氯气,溶液变为红色,证明该未知溶液含有Fe2+离子;
则请回答:①你认为哪个方案较为合理
方案二
方案二
;②写出Fe2+与氯气反应的离子方程式
Cl2+2Fe2+=2Fe3++2Cl-
Cl2+2Fe2+=2Fe3++2Cl-
;⑧实验室在保存含有Fe2+离子的溶液时,为了防止Fe2+离子变质,经常向其中加入铁粉,其原因是(用离子方程式表示)
2Fe3++Fe=3Fe2+
2Fe3++Fe=3Fe2+
;(4)鲜榨苹果汁是人们喜爱的饮料.由于此饮料中含有Fe2+,鲜榨的苹果汁在空气中会由淡绿色的Fe2+变为棕黄色的Fe3+,则这个变色的过程中Fe2+被
氧化
氧化
;若在榨汁的时候加入适量的维生素C,可有效防止这种现象的发生.这说明维生素C具有B
B
.A.氧化性 B.还原性 C.酸性 D.碱性.