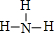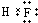题目内容
(1)除去铁粉中混有的铝粉可以选用的试剂为
A.稀盐酸 B,氢氧化钠溶液 C.浓硫酸 D.硝酸
需要进行的分离操作是
(2)向一支装有FeC3溶液的试管中滴加NaOH溶液,现象为
(3)为了检验某未知溶液是否含有Fe2+离子,两位同学分别设计了以下实验方案加以证明.
方案一:向一支装有该未知溶液的试管中先通入氯气,再滴加KSCN溶液,溶液呈现红色,证明该未知溶液含有Fe2+离子;
方案二:向另一支装有该未知溶液的试管中先滴加KSCN溶液,无现象,再通入氯气,溶液变为红色,证明该未知溶液含有Fe2+离子;
则请回答:①你认为哪个方案较为合理
②写出Fe2+与氯气反应的离子方程式
⑧实验室在保存含有Fe2+离子的溶液时,为了防止Fe2+离子变质,经常向其中加入铁粉,其原因是(用离子方程式表示)
(4)鲜榨苹果汁是人们喜爱的饮料.由于此饮料中含有Fe2+,鲜榨的苹果汁在空气中会由淡绿色的Fe2+变为棕黄色的Fe3+,则这个变色的过程中Fe2+被
A.氧化性 B.还原性 C.酸性 D.碱性.
(2)氯化铁和氢氧化钠反应生成氢氧化铁红褐色沉淀氢氧化铁;
(3)①方案一先通氯气再加入硫氰酸钾溶液,原溶液中可能含有铁离子;方案二先加入硫氰酸钾无现象证明无铁离子,通入氯气变血红色证明含亚铁离子;
②亚铁离子被氯气氧化为铁离子;
③加入铁可以把氧化生成的铁离子还原为亚铁离子防止氧化;
(4)依据铁元素化合价变化由淡绿色的Fe2+变为棕黄色的Fe3+,是被氧化为铁离子,维生素C具有还原性把铁离子还原为亚铁离子;
反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:B,过滤,2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)向一支装有FeCl3溶液的试管中滴加NaOH溶液反应生成红褐色沉淀氢氧化铁;
故答案为:红褐色沉淀,Fe(OH)3;
(3)①向一支装有该未知溶液的试管中先通入氯气,再滴加KSCN溶液,原溶液中含有铁离子,溶液也可以呈现红色,所以方案一不正确;
向另一支装有该未知溶液的试管中先滴加KSCN溶液,无现象证明无铁离子,再通入氯气,溶液变为红色,证明原溶液中含有亚铁离子,方案正确;
故答案为:方案二;
②Fe2+与氯气反应的离子方程式为Cl2+2Fe2+=2Fe3++2Cl-;故答案为:Cl2+2Fe2+=2Fe3++2Cl-;
③为了防止Fe2+离子变质,经常向其中加入铁粉会防止亚铁离子被氧化,铁和铁离子反应生成亚铁离子,反应的离子方程式为:2Fe3++Fe=3Fe2+;
故答案为:2Fe3++Fe=3Fe2+;
(4)鲜榨的苹果汁在空气中会由淡绿色的Fe2+变为棕黄色的Fe3+,是因为亚铁离子内氧化为铁离子,亚铁离子表现了还原性被氧化为铁离子;维生素C具有还原性能含有铁离子,故选B;故答案为:氧化,B.

 阅读快车系列答案
阅读快车系列答案 I、表中①~⑥为部分短周期元素的化合价及原子半径
| 元素性质[ | 元素编号[来源:学*科*网Z*X*X*K] | |||||
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 原子半径/nm | 0.102 | 0.110 | 0.074 | 0.075 | 0.071 | 0.099 |
| 最高化合价 | +6 | +5 | | +5 | | +7 |
| 最低化合价 | -2 | -3 | -2 | -3 | -1 | -1 |
III、A与B两元素可形成化合物AB、AB2,二者均可用于制备化合物乙。
A、B、C均为上表中的元素,甲、乙为中学常见强酸。
请回答下列问题
(1)写出B元素位于周期表中的位置__________________
(2)A元素气态氢化物的结构式为_____,写出上述元素形成的最稳定的氢化物的电子式____
(3)下列关于物质甲、乙的说法中正确的是__________(填字母)
a.二者的浓溶液在常温时均可用铁制容器贮存
b.二者的浓溶液在敞口容器中放置,质量都会变化
c.二者的浓溶液在常温时均与铜反应 d.二者的稀溶液均具有强氧化性
(4)请写出工业上由CB2制备CB3的化学方程式___________________________。写出工业生产强酸乙的过程中制备化合物AB的化学方程式______________
I、表中①~⑥为部分短周期元素的化合价及原子半径
|
元素性质[ |
元素编号[来源:学*科*网Z*X*X*K] |
|||||
|
① |
② |
③ |
④ |
⑤ |
⑥ |
|
|
原子半径/nm |
0.102 |
0.110 |
0.074 |
0.075 |
0.071 |
0.099 |
|
最高化合价 |
+6 |
+5 |
|
+5 |
|
+7 |
|
最低化合价 |
-2 |
-3 |
-2 |
-3 |
-1 |
-1 |
II、B与C两元素可形成化合物CB2、CB3,二者均可用于制备化合物甲
III、A与B两元素可形成化合物AB、AB2,二者均可用于制备化合物乙。
A、B、C均为上表中的元素,甲、乙为中学常见强酸。
请回答下列问题
(1)写出B元素位于周期表中的位置__________________
(2)A元素气态氢化物的结构式为_____,写出上述元素形成的最稳定的氢化物的电子式____
(3)下列关于物质甲、乙的说法中正确的是__________(填字母)
a.二者的浓溶液在常温时均可用铁制容器贮存
b.二者的浓溶液在敞口容器中放置,质量都会变化
c.二者的浓溶液在常温时均与铜反应 d.二者的稀溶液均具有强氧化性
(4)请写出工业上由CB2制备CB3的化学方程式___________________________。写出工业生产强酸乙的过程中制备化合物AB的化学方程式______________
I、表中①~⑥为部分短周期元素的化合价及原子半径
|
元素性质[ |
元素编号[来源:学*科*网Z*X*X*K] |
|||||
|
① |
② |
③ |
④ |
⑤ |
⑥ |
|
|
原子半径/nm |
0.102 |
0.110 |
0.074 |
0.075 |
0.071 |
0.099 |
|
最高化合价 |
+6 |
+5 |
|
+5 |
|
+7 |
|
最低化合价 |
-2 |
-3 |
-2 |
-3 |
-1 |
-1 |
II、B与C两元素可形成化合物CB2、CB3,二者均可用于制备化合物甲
III、A与B两元素可形成化合物AB、AB2,二者均可用于制备化合物乙。
A、B、C均为上表中的元素,甲、乙为中学常见强酸。
请回答下列问题
(1)写出B元素位于周期表中的位置__________________
(2)A元素气态氢化物的结构式为_____,写出上述元素形成的最稳定的氢化物的电子式____
(3)下列关于物质甲、乙的说法中正确的是__________(填字母)
a.二者的浓溶液在常温时均可用铁制容器贮存
b.二者的浓溶液在敞口容器中放置,质量都会变化
c.二者的浓溶液在常温时均与铜反应 d.二者的稀溶液均具有强氧化性
(4)请写出工业上由CB2制备CB3的化学方程式___________________________。写出工业生产强酸乙的过程中制备化合物AB的化学方程式______________