摘要:12.(1) H2SiF6+6NH4HCO3=6NH4F+H2SiO3↓+6CO2↑+3H2O NaF比NaCl的溶解性小 除去NaF .NH4Cl 表面的杂质 (4) 加热蒸发溶剂.析出多量固体后冷却 (5) 必须保证H2SiF6能全部反应.防止在进行反应Ⅱ时H2SiF6将与NaCl反应.生成Na2SiF6沉淀.混入NaF中影响NaF质量 (本题共12分.每空2分.其它合理答案参照给分)
网址:http://m.1010jiajiao.com/timu3_id_68729[举报]
(2010?大连二模)[选修-化学与技术]
氟化钠是一种微溶于水的盐,实验室可通过图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵;
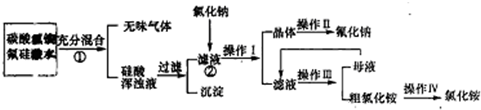
已知:20℃时氯化铵的溶解度为37.2g,Na2SiF6微溶于水,请回答下列问题:
(1)上述流程中①②分别发生化学反应,写出相关的化学方程式:
①
(2)请指出I-IV实验操作的名称;操作I
(3)操作II的具体过程是
(4)流程①中的NH4HCO3必须过量,其原因的是
查看习题详情和答案>>
氟化钠是一种微溶于水的盐,实验室可通过图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵;

已知:20℃时氯化铵的溶解度为37.2g,Na2SiF6微溶于水,请回答下列问题:
(1)上述流程中①②分别发生化学反应,写出相关的化学方程式:
①
H2SiF6+6NH4HCO3═6NH4F+H2SiO3↓+6CO2↑+3H2O
H2SiF6+6NH4HCO3═6NH4F+H2SiO3↓+6CO2↑+3H2O
;②NH4F+NaCl═NaF↓+NH4Cl
NH4F+NaCl═NaF↓+NH4Cl
;(2)请指出I-IV实验操作的名称;操作I
过滤
过滤
,操作II结晶
结晶
,操作III洗涤
洗涤
,操作IV重结晶
重结晶
.(3)操作II的具体过程是
待母液全部滤出后,再向滤纸上加蒸馏水至恰好浸没晶体,静置让其滤出,重复操作2-3次,以除去晶体表面的杂质
待母液全部滤出后,再向滤纸上加蒸馏水至恰好浸没晶体,静置让其滤出,重复操作2-3次,以除去晶体表面的杂质
.(4)流程①中的NH4HCO3必须过量,其原因的是
保证H2SiF6能全部反应,防止生成Na2SiF6沉淀,混入NaF中影响NaF质量
保证H2SiF6能全部反应,防止生成Na2SiF6沉淀,混入NaF中影响NaF质量
.氟化钠是一种重要的氟盐,主要用作农业杀菌剂、杀虫剂、木材防腐剂.实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵:

有关物质在水中溶解度分别为:氯化铵:10℃时33.3g、20℃时37.2g、30℃时41.4g;氟化钠:20℃时4g;氟硅酸钠微溶于水.
请回答下列问题:
(1)上述流程中氟硅酸(H2SiF6)等物质混合时发生的反应的化学方程式为:
(2)操作Ⅰ需要用到的玻璃仪器除玻璃棒外,还有
(3)操作II的作用是
(4)操作Ⅲ的具体过程是
(5)流程中NH4HCO3必须过量,其原因是
查看习题详情和答案>>

有关物质在水中溶解度分别为:氯化铵:10℃时33.3g、20℃时37.2g、30℃时41.4g;氟化钠:20℃时4g;氟硅酸钠微溶于水.
请回答下列问题:
(1)上述流程中氟硅酸(H2SiF6)等物质混合时发生的反应的化学方程式为:
H2SiF6+6NH4HCO3+H2O=6NH4F+H2SiO3↓+6CO2↑
H2SiF6+6NH4HCO3+H2O=6NH4F+H2SiO3↓+6CO2↑
,在滤液中加入NaCl的目的是增加Na+浓度,促进NaF沉淀
增加Na+浓度,促进NaF沉淀
.(2)操作Ⅰ需要用到的玻璃仪器除玻璃棒外,还有
烧杯、漏斗
烧杯、漏斗
.(3)操作II的作用是
洗涤,以除去NaF、NH4Cl表面的杂质
洗涤,以除去NaF、NH4Cl表面的杂质
.(4)操作Ⅲ的具体过程是
蒸发浓缩,析出大量固体后冷却结晶
蒸发浓缩,析出大量固体后冷却结晶
.(5)流程中NH4HCO3必须过量,其原因是
保证H2SiF6能全部反应;防止在进行反应Ⅱ时有残余H2SiF6与NaCl反应,生成Na2SiF6沉淀,使所得产品不纯
保证H2SiF6能全部反应;防止在进行反应Ⅱ时有残余H2SiF6与NaCl反应,生成Na2SiF6沉淀,使所得产品不纯
.(2009?肇庆二模)氟化钠是一种重要的氟盐,主要用作农业杀菌剂、杀虫剂、木材防腐剂和生产含氟牙膏等.实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵:
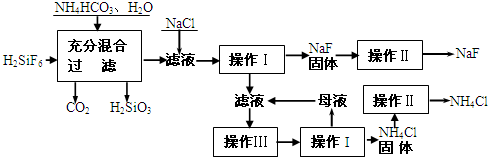
有关物质在水中溶解度见下表.请回答下列问题:
(1)操作Ⅰ需要用到的玻璃仪器有玻璃棒、烧杯、
(2)上述流程中发生两步化学反应,第一步反应的化学方程式为:
(3)操作II的作用是
(4)流程中NH4HCO3必须过量,其原因是
(5)NaF可用于生产含氟牙膏,使用含氟牙膏可以预防龋齿.请说明含有NaF的牙膏如何将羟基磷酸钙[Ca5(PO4)3(OH)]转化为更难溶的氟磷酸钙[Ca5(PO4)3F]
查看习题详情和答案>>

有关物质在水中溶解度见下表.请回答下列问题:
| 温度 | 10℃ | 20℃ | 30℃ | 溶解度:20℃NaF-4g;0℃NH4F-100g; 常温Na2SiF6-微溶于水 |
| NH4Cl溶解度 | 33.3g | 37.2g | 41.4g |
漏斗
漏斗
.(2)上述流程中发生两步化学反应,第一步反应的化学方程式为:
H2SiF6+6NH4HCO3=6NH4F+H2SiO3↓+6CO2↑+3H2O
H2SiF6+6NH4HCO3=6NH4F+H2SiO3↓+6CO2↑+3H2O
,第二步反应的化学方程式为NH4F+NaCl=NH4Cl+NaF↓
NH4F+NaCl=NH4Cl+NaF↓
.(3)操作II的作用是
除去NaF、NH4Cl表面的杂质
除去NaF、NH4Cl表面的杂质
;操作Ⅲ的具体过程是蒸发浓缩溶液,析出多量固体后冷却
蒸发浓缩溶液,析出多量固体后冷却
.(4)流程中NH4HCO3必须过量,其原因是
保证H2SiF6能全部反应;防止在加入NaCl后H2SiF6与NaCl反应生成Na2SiF6沉淀混入NaF中影响NaF纯度
保证H2SiF6能全部反应;防止在加入NaCl后H2SiF6与NaCl反应生成Na2SiF6沉淀混入NaF中影响NaF纯度
.(5)NaF可用于生产含氟牙膏,使用含氟牙膏可以预防龋齿.请说明含有NaF的牙膏如何将羟基磷酸钙[Ca5(PO4)3(OH)]转化为更难溶的氟磷酸钙[Ca5(PO4)3F]
羟基磷酸钙在水中存在溶解平衡:Ca5(PO4)3(OH)?5Ca2++3PO43-+OH-,当F-与Ca2+、PO43-结合生成了更难溶于水的Ca5(PO4)3F,使上述平衡中Ca2+和PO43-减少而向右移动,继续生成更多的Ca5(PO4)3F,难溶物发生了转化
羟基磷酸钙在水中存在溶解平衡:Ca5(PO4)3(OH)?5Ca2++3PO43-+OH-,当F-与Ca2+、PO43-结合生成了更难溶于水的Ca5(PO4)3F,使上述平衡中Ca2+和PO43-减少而向右移动,继续生成更多的Ca5(PO4)3F,难溶物发生了转化
.Ⅰ下列实验操作或对实验事实的描述正确的是 (填序号);
①实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉.
②配制一定浓度的溶液时,俯视容量瓶的刻线,会使配制的浓度偏高;实验室测定中和热时,过早读数会使测定结果偏低.
③将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到红棕色粉末
④实验室用铜片与稀硝酸反应产生的气体可用排水法收集
⑤试管中加入少量淀粉,再加入一定量稀硫酸,加热3-4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现
⑥向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
⑦苯与溴水在铁粉的催化作用下制备溴苯
⑧分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
Ⅱ氟化钠是一种重要的氟盐,主要用于农作物杀菌、杀虫、木材的防腐.实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵;
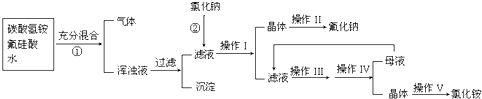
已知:20℃时氯化铵的溶解度为37.2g,氟化钠的溶解度为4g.Na2SiF6微溶于水.请回答下列问题:
(1)上述流程①中产生浑浊的原因是生成了 (选择序号);
A.NH4F B.H2SiO3C.(NH4)2SiF6 D.(NH4)2CO3
(2)写出流程②中相关的化学方程式: ;
(3)操作I和操作 是相同的,操作II和操作V是相同的,其操作名称为 ;
(4)流程①中NH4HCO3必须过量,其原因是 .
查看习题详情和答案>>
①实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉.
②配制一定浓度的溶液时,俯视容量瓶的刻线,会使配制的浓度偏高;实验室测定中和热时,过早读数会使测定结果偏低.
③将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到红棕色粉末
④实验室用铜片与稀硝酸反应产生的气体可用排水法收集
⑤试管中加入少量淀粉,再加入一定量稀硫酸,加热3-4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现
⑥向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
⑦苯与溴水在铁粉的催化作用下制备溴苯
⑧分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
Ⅱ氟化钠是一种重要的氟盐,主要用于农作物杀菌、杀虫、木材的防腐.实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵;

已知:20℃时氯化铵的溶解度为37.2g,氟化钠的溶解度为4g.Na2SiF6微溶于水.请回答下列问题:
(1)上述流程①中产生浑浊的原因是生成了
A.NH4F B.H2SiO3C.(NH4)2SiF6 D.(NH4)2CO3
(2)写出流程②中相关的化学方程式:
(3)操作I和操作
(4)流程①中NH4HCO3必须过量,其原因是
(2011?嘉兴模拟)氟化钠的用途非常广泛,可作杀菌剂、杀虫剂和木材防腐剂.实验室可通过下图所示的流程来制取:

请结合每小题的相关信息,回答下列有关问题:
(1)已知:饱和氟硅酸(H2SiF6)溶液为无色透明的发烟液体,密度为1.32g?mLˉ1,易挥发,有刺激性气味,与等物质的量浓度的H2SO4酸性相当,它对玻璃、陶瓷都有较强的腐蚀性.以上实验所用仪器全部用聚酯类材料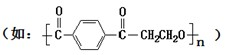 做成,在该类材料做成的容器中混合NH4HCO3固体、H2SiF6浓溶液和H2O时,加入试剂的顺序应是
做成,在该类材料做成的容器中混合NH4HCO3固体、H2SiF6浓溶液和H2O时,加入试剂的顺序应是
A.玻璃 B.铁 C.聚乳酸 D.陶瓷
(2)已知在20℃时Na2SiF6的溶解度为2.12g,请写出1L 1mol?Lˉ1的H2SiF6溶液与1L 1mol?Lˉ1Na2CO3溶液混合后(假设混合液中水的质量约等于2000g)发生化学反应的离子方程式为
(3)上述流程图中产生浑浊液的原因是生成了
A.NH4F B.H2SiO3 C.(NH4)2SiF6 D.(NH4)2CO3
(4)操作1后是否需要对沉淀进行洗涤
(5)溶液B中经操作
查看习题详情和答案>>

请结合每小题的相关信息,回答下列有关问题:
(1)已知:饱和氟硅酸(H2SiF6)溶液为无色透明的发烟液体,密度为1.32g?mLˉ1,易挥发,有刺激性气味,与等物质的量浓度的H2SO4酸性相当,它对玻璃、陶瓷都有较强的腐蚀性.以上实验所用仪器全部用聚酯类材料
 做成,在该类材料做成的容器中混合NH4HCO3固体、H2SiF6浓溶液和H2O时,加入试剂的顺序应是
做成,在该类材料做成的容器中混合NH4HCO3固体、H2SiF6浓溶液和H2O时,加入试剂的顺序应是NH4HCO3固体、H2O和H2SiF6浓溶液
NH4HCO3固体、H2O和H2SiF6浓溶液
,加好试剂后,为了让它们充分反应,不能用C
C
棒搅拌(填字母).A.玻璃 B.铁 C.聚乳酸 D.陶瓷
(2)已知在20℃时Na2SiF6的溶解度为2.12g,请写出1L 1mol?Lˉ1的H2SiF6溶液与1L 1mol?Lˉ1Na2CO3溶液混合后(假设混合液中水的质量约等于2000g)发生化学反应的离子方程式为
2H++SiF62-+2Na++CO32-=Na2SiF6↓+CO2↑+H2O
2H++SiF62-+2Na++CO32-=Na2SiF6↓+CO2↑+H2O
.(3)上述流程图中产生浑浊液的原因是生成了
B
B
(填字母).A.NH4F B.H2SiO3 C.(NH4)2SiF6 D.(NH4)2CO3
(4)操作1后是否需要对沉淀进行洗涤
是
是
(填“是”或“否”),选择“是”或“否”的原因是使沉淀表面吸附的NH4F全部转移到溶液A中,提高产品产率
使沉淀表面吸附的NH4F全部转移到溶液A中,提高产品产率
.(5)溶液B中经操作
蒸发浓缩、冷却结晶、过滤
蒸发浓缩、冷却结晶、过滤
可得到副产品氯化铵;粗产品晶体经重结晶
重结晶
(填操作名称)可得纯净的产品.