题目内容
①实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉.
②配制一定浓度的溶液时,俯视容量瓶的刻线,会使配制的浓度偏高;实验室测定中和热时,过早读数会使测定结果偏低.
③将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到红棕色粉末
④实验室用铜片与稀硝酸反应产生的气体可用排水法收集
⑤试管中加入少量淀粉,再加入一定量稀硫酸,加热3-4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现
⑥向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
⑦苯与溴水在铁粉的催化作用下制备溴苯
⑧分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
Ⅱ氟化钠是一种重要的氟盐,主要用于农作物杀菌、杀虫、木材的防腐.实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵;
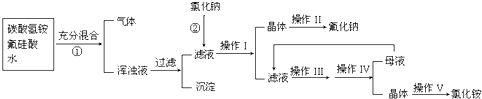
已知:20℃时氯化铵的溶解度为37.2g,氟化钠的溶解度为4g.Na2SiF6微溶于水.请回答下列问题:
(1)上述流程①中产生浑浊的原因是生成了
A.NH4F B.H2SiO3C.(NH4)2SiF6 D.(NH4)2CO3
(2)写出流程②中相关的化学方程式:
(3)操作I和操作
(4)流程①中NH4HCO3必须过量,其原因是
②俯视容量瓶的刻线,液面在刻度线下方,溶液体积偏小,会使配制的浓度偏高;实验室测定中和热时,过早读数会使温度偏低,据此分析判断;
③铁离子水解,硫酸是非挥发性酸,最终又生成硫酸铁;
④NO由于氧气反应,且NO不溶水,应用排水法收集;
⑤银镜反应需要在碱性条件下进行;
⑥铝离子与氨水反应生成氢氧化铝沉淀,氢氧化铝不溶于弱碱;
⑦制备溴苯需要液溴;
⑧pH相同的盐酸和醋酸,醋酸的浓度原大于盐酸的浓度,等条件下醋酸消耗的氢氧化钠更多.
Ⅱ根据已知反应物和生成物,结合工艺流程可知,反应①为H2SiF6与NH4HCO3反应,生成的无味气体为CO2,过滤硅酸浑浊液,向滤液加入氯化钠,经过系列操作可得氟化钠、氯化铵,故滤液中含有氟化铵,故反应①为H2SiF6与NH4HCO3反应,生成CO2、硅酸、氟化铵,根据元素守恒还有水生成;
反应②加入的反应物为NaCl,NaF比NaCl的溶解性小,是将第一步生成的NH4F转化为NaF;
加入的反应物为NaCl,NaF比NaCl的溶解性小,利用了物质在溶液中溶解度越小则优先析出的特性.操作Ⅰ是把固体与液体分离操作,应是过滤操作;操作II是将粗NaF洗涤除去其表面的杂质;操作Ⅲ是将滤液中的溶质进一步提取,应加热蒸发溶剂,析出大量固体后冷却,应是结晶;操作IV是把固体与液体分离操作,应是过滤操作;操作V是洗涤除去其表面的杂质.
②俯视容量瓶的刻线,液面在刻度线下方,溶液体积偏小,所配溶液浓度偏高;实验室测定中和热时,过早读数会使温度偏低,测定的中和热偏低,故②正确;
③铁离子水解,硫酸是非挥发性酸,最终有生成硫酸铁,加热灼烧硫酸铁分解,不能得到氧化铁,故③错误;
④NO由于氧气反应,且NO不溶水,应用排水法收集,故④正确;
⑤淀粉水解后,没有加减至碱性,就进行银镜反应,不能产生“银镜”现象,故⑤错误;
⑥铝离子与氨水反应生成氢氧化铝沉淀,氨水是弱碱,不能溶解氢氧化铝,故⑥正确;
⑦苯与液溴在铁粉的催化作用下制备溴苯,不能利用溴水,故⑦错误;
⑧pH相同的盐酸和醋酸,醋酸的浓度原大于盐酸的浓度,等条件下醋酸消耗的氢氧化钠更多,故⑧错误;
故答案为:①②④⑥;
Ⅱ(1)反应①为H2SiF6与NH4HCO3反应,生成CO2、硅酸、氟化铵、水,反应方程式为:H2SiF6+6NH4HCO3═6NH4F+H2SiO3↓+6CO2↑+3H2O,故答案为:B;
(2)反应②是将第一步生成的NH4F转化为NaF,反应方程式为:NH4F+NaCl═NaF↓+NH4Cl,故答案为:NH4F+NaCl═NaF↓+NH4Cl;
(3)操作Ⅰ是把固体与液体分离操作,应是过滤操作;
操作II是将粗NaF洗涤除去其表面的杂质;
操作Ⅲ是将滤液中的溶质进一步提取,应加热蒸发溶剂,析出大量固体后冷却,应是结晶;
操作IV是把固体与液体分离操作,应是过滤操作,
操作V是洗涤除去其表面的杂质.
故答案为:IV;洗涤;
(4)流程中NH4HCO3必须过量,是指第一步操作中必须保证H2SiF6能全部反应,防止生成Na2SiF6沉淀,防止在进行反应②H2SiF6将与NaCl反应,生成Na2SiF6沉淀,混入NaF中影响NaF质量,
故答案为:必须保证H2SiF6能全部反应,防止②中生成Na2SiF6沉淀.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案(2011?闵行区二模)通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一,对下列实验现象或实操作解释正确的是( )
|
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一,对下列实验现象或实操作解释正确的是
|
|
现象或操作 |
解 释 |
|
A |
KI淀粉溶液中通入Cl2溶液变蓝 |
Cl2能与淀粉发生显色反应 |
|
B |
苯酚中滴加溴水有白色沉淀 |
苯酚与溴发生了加成反应 |
|
C |
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 |
说明该溶液中含有SO42- |
|
D |
蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
此位置指示的是被蒸馏物质的沸点 |
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一,对下列实验现象或实操作解释正确的是
| 现象或操作 | 解 释 |
A | KI淀粉溶液中通人Cl2溶液变蓝 | Cl2能与淀粉发生显色反应 |
B | 苯酚中滴加溴水有白色沉淀 | 苯酚与溴发生了加成反应 |
C | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 说明该溶液中含有SO42- |
D | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | 此位置指示的是被蒸馏物质的沸点 |
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一,对下列实验现象或实操作解释正确的是
| 现象或操作 | 解 释 | |
| A | KI淀粉溶液中通入Cl2溶液变蓝 | Cl2能与淀粉发生显色反应 |
| B | 苯酚中滴加溴水有白色沉淀 | 苯酚与溴发生了加成反应 |
| C | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 说明该溶液中含有SO42- |
| D | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | 此位置指示的是被蒸馏物质的沸点 |
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一,对下列实验现象或实操作解释正确的是
|
| 现象或操作 | 解 释 |
| A | KI淀粉溶液中通入Cl2溶液变蓝 | Cl2能与淀粉发生显色反应 |
| B | 苯酚中滴加溴水有白色沉淀 | 苯酚与溴发生了加成反应 |
| C | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 说明该溶液中含有SO42- |
| D | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | 此位置指示的是被蒸馏物质的沸点 |