题目内容
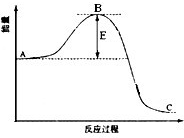 合成氨反应过程中的能量变化如图所示,据图回答下列问题:
合成氨反应过程中的能量变化如图所示,据图回答下列问题:(1)该反应通常用活性铁作催化剂,加活性铁会使图中B点
降低
降低
(填升高、降低或不变),理由是因为催化剂改变了反应的历程使活化能E降低
因为催化剂改变了反应的历程使活化能E降低
;(2)该反应平衡常数表达式为:K=
| [NH3]2 |
| [N2][H2]3 |
| [NH3]2 |
| [N2][H2]3 |
<
<
K(填“<”、“>”或“=”)时,反应向右进行.(3)450℃时该反应的平衡常数
>
>
500℃时的平衡常数(填“<”、“>”或“=”).(4)一定条件下的密闭容器中,该反应达到平衡,要提高H2的转化率,可以采取的措施是
ce
ce
(填字母代号).a.高温高压 b.加入催化剂 c.增加N2的浓度
d.增加H2的浓度 e.分离出NH3
(5)在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3的浓度(mol?L-1) | c1 | c2 | c3 |
| 反应物转化率 | a1 | a2 | a3 |
BC
BC
.A.c1<c2 B.2c1<c3 C.a1+a2=1 D. a2<a3.
分析:(1)催化剂是通过降低反应的活化能来加快化学反应速率的;
(2)根据平衡常数表达式的书写方法以及Q和K的大小关系来回答;
(3)对于放热反应温度越低平衡常数越大;
(4)根据影响化学平衡移动的因素知识来回答判断;
(5)根据等效原理:投入物质1molN2、3molH2和2molNH3是等效的,根据影响化学平衡移动的因素知识来回答.
(2)根据平衡常数表达式的书写方法以及Q和K的大小关系来回答;
(3)对于放热反应温度越低平衡常数越大;
(4)根据影响化学平衡移动的因素知识来回答判断;
(5)根据等效原理:投入物质1molN2、3molH2和2molNH3是等效的,根据影响化学平衡移动的因素知识来回答.
解答:解:(1)催化剂是通过降低反应的活化能来加快化学反应速率的,所以加活性铁会使图中B点降低,故答案为:降低;因为催化剂改变了反应的历程使活化能E降低;
(2)合成氨的平衡常数表达式为:K=
,根据K和Q的关系,当浓度商Q<K时,反应向右进行,直到达到平衡状态,故答案为:
;<;
(3)合成氨的反应是放热反应,当温度升高,则平衡常数减小,故答案为:>;
(4)一定条件下的密闭容器中,该反应达到平衡,要提高H2的转化率,即让化学平衡正向进行即可,可以增加反应物N2的浓度、分离出NH3(减小生成物的浓度),高温条件会使平衡向左进行,加入催化剂不会改变反应物的转化率,增加H2的浓度会使得氢气的转化率减小,故答案为:ce;
(5)根据等效原理:投入物质1molN2、3molH2和2molNH3是等效的,所以a1+a2=1,c1=c2,投入4mol的氨气,是甲和乙投入量的2倍,但是压强增大的同时,化学平衡会向正向移动,所以2c1<c3,
故答案为:BC.
(2)合成氨的平衡常数表达式为:K=
| [NH3]2 |
| [N2][H2]3 |
| [NH3]2 |
| [N2][H2]3 |
(3)合成氨的反应是放热反应,当温度升高,则平衡常数减小,故答案为:>;
(4)一定条件下的密闭容器中,该反应达到平衡,要提高H2的转化率,即让化学平衡正向进行即可,可以增加反应物N2的浓度、分离出NH3(减小生成物的浓度),高温条件会使平衡向左进行,加入催化剂不会改变反应物的转化率,增加H2的浓度会使得氢气的转化率减小,故答案为:ce;
(5)根据等效原理:投入物质1molN2、3molH2和2molNH3是等效的,所以a1+a2=1,c1=c2,投入4mol的氨气,是甲和乙投入量的2倍,但是压强增大的同时,化学平衡会向正向移动,所以2c1<c3,
故答案为:BC.
点评:本题是一道关于化学平衡的移动以及化学平衡常数知识的一道综合题目,考查学生分析和解决问题的能力,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
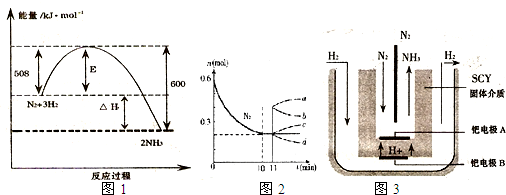

 (1)右图表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答:
(1)右图表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答:
 (3)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下吧氢气和用氦气稀释的氮气,分别通人一个加热到500℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质理用吸附在它内外表面上的金属但多晶薄膜像电噪,实现了常压、570℃条件下高转化率的电解法合成氮(装置如图)。
(3)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下吧氢气和用氦气稀释的氮气,分别通人一个加热到500℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质理用吸附在它内外表面上的金属但多晶薄膜像电噪,实现了常压、570℃条件下高转化率的电解法合成氮(装置如图)。
 2NH3,是哈伯于1905年发明的,但此法达到平衡时反应物的转化率不高。
2NH3,是哈伯于1905年发明的,但此法达到平衡时反应物的转化率不高。 2NH3的反应,左下图表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=_______________。从11min起,压缩容器的体积为
2NH3的反应,左下图表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=_______________。从11min起,压缩容器的体积为