摘要:3.乙炔 (1)点燃纯净的乙炔 实验:点燃纯净的乙炔.观察乙炔燃烧时的现象. 现象与解释:乙炔燃烧时.火焰明亮.并伴有浓烈的黑烟.这是乙炔中碳的质量分数比乙烯还高.碳没有完全燃烧的缘故. (2)乙炔使KMnO4酸性溶液褪色 实验:把纯净的乙炔通入盛有KMnO4酸性溶液的试管里.观察试管里溶液颜色的变化. 现象与解释:KMnO4酸性溶液的紫色褪去.说明乙炔能与KMnO4酸性溶液反应. (3)乙炔使溴的四氯化碳溶液褪色 实验:把纯净的乙炔通入盛有盛有溴的四氯化碳溶液的试管里.观察试管里溶液颜色的变化. 现象与解释:溴的红棕色褪去.说明乙炔也能与溴发生加成反应.
网址:http://m.1010jiajiao.com/timu3_id_67265[举报]
如图为实验室制取乙炔并验证其性质的装置图.下列说法不合理的是( )
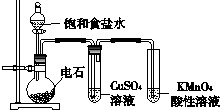

| A、逐滴加入饱和食盐水可控制生成乙炔的速率 | B、KMnO4酸性溶液褪色,说明乙炔具有还原性 | C、用Br2的CCl4溶液验证乙炔的性质,不需要除杂 | D、将纯净的乙炔点燃,有浓烈的黑烟,说明乙炔不饱和程度高 |
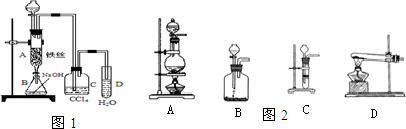
(1)某化学课外小组用右图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
①据图1写出A中有机反应的化学方程式
②已知上述有机反应是放热反应.观察到A中的现象是
③实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是
④C中盛放CCl4的作用是
⑤能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中滴入AgNO3溶液,若产生淡黄色沉淀,则能证明.另一种验证的方法是向试管D中加入
(2)图2是乙炔的实验室制法
①反应原理
②选择合适的制取实验装置
③实验中常用饱和食盐水代替水,目的是
④纯净的乙炔气体是无色无味的气体,用电石和水反应制取的乙炔,常含有H2S和PH3而有恶臭气味.可以用
查看习题详情和答案>>
①据图1写出A中有机反应的化学方程式
C6H6+Br2
C6H5Br+HBr
| Fe |
C6H6+Br2
C6H5Br+HBr
| Fe |
②已知上述有机反应是放热反应.观察到A中的现象是
反应液微沸
反应液微沸
及有红棕色气体充满A容器
有红棕色气体充满A容器
.③实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是
除去溶于溴苯中的溴
除去溶于溴苯中的溴
,写出有关的化学方程式Br2+2NaOH=NaBr+NaBrO+H2O或3Br2+6NaOH=5NaBr+NaBrO3+3H2O
Br2+2NaOH=NaBr+NaBrO+H2O或3Br2+6NaOH=5NaBr+NaBrO3+3H2O
.④C中盛放CCl4的作用是
除去溴化氢气体中的溴蒸气
除去溴化氢气体中的溴蒸气
.⑤能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中滴入AgNO3溶液,若产生淡黄色沉淀,则能证明.另一种验证的方法是向试管D中加入
石蕊试液
石蕊试液
,现象是溶液变红色
溶液变红色
.(2)图2是乙炔的实验室制法
①反应原理
CaC2+2H2O→C2H2↑+Ca(OH)2
CaC2+2H2O→C2H2↑+Ca(OH)2
.②选择合适的制取实验装置
B
B
.③实验中常用饱和食盐水代替水,目的是
减缓电石与水的反应速率
减缓电石与水的反应速率
.④纯净的乙炔气体是无色无味的气体,用电石和水反应制取的乙炔,常含有H2S和PH3而有恶臭气味.可以用
硫酸铜
硫酸铜
溶液除去杂质气体.