网址:http://m.1010jiajiao.com/timu3_id_66561[举报]
有A、B、C三种元素。已知:
①4 g A元素的单质与水作用,标准状况下放出H2 2.24 L,反应中有1.204×1023个电子发生转移;
②B元素可与A形成AB2型的离子化合物,且知A、B的离子具有相同的核外电子排布;
③元素C的气态氢化物可与其最高价氧化物的水化物发生非氧化还原反应生成盐,1 mol该盐含42个电子。
据此填写下列空白:
(1)元素符号:A__________,B__________,C__________。
(2)A元素的离子结构示意图:_____________。
(3)用电子式表示AB2的形成过程:__________________________________________。
(4)C的气态氢化物在催化剂作用下与O2反应的化学方程式:__________________________。
(5)用电子式表示C的气态氢化物的形成过程:_____________________________________。它与B的气态氢化物反应时有_________现象发生,生成物的电子式为:__________,它属于______晶体。
查看习题详情和答案>>A.大于49% B.等于49% C.小于49% D.无法确定
查看习题详情和答案>>
已知:
I.
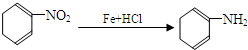 (苯胺,易被氧化)
(苯胺,易被氧化)Ⅱ.
 (X为Cl或Br)
(X为Cl或Br)Ⅲ.大多数苯的同系物易被酸性KmnO4氧化为苯甲酸
(1)B的结构简式为:
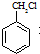

(2)符合下列条件的扁桃酸的同分异构体共有
①于甲酸酯 ②含有酚羟基
(3)反应③和④顺序能否对换?
(4)写出反应⑤的化学方程式:
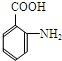
| 一定条件 |
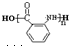 +(n-1)H2O
+(n-1)H2O
| 一定条件 |
 +(n-1)H2O
+(n-1)H2O(5)试写出由A合成水杨酸的合理流程图:


①合成过程中无机试剂任选
②合成反应流程图表示方法示例如下:

工业上以铬铁矿(主要成分![]() )、碳酸钠、氧气和硫酸为原料生产重铬酸钠(
)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(![]() )的主要反应如下:
)的主要反应如下:
①![]()
②![]()
![]()
![]()
(1)工业上反应①需不断搅拌,其目的是____________________。
(2)下图是红矾钠(![]() )和
)和![]() 的溶解度曲线。
的溶解度曲线。

从![]() 和
和![]() 的混合溶液中提取
的混合溶液中提取![]() 晶体的操作:先将混合溶液蒸发浓缩,趁热过滤。然后将滤液冷却结晶,从而析出红矾钠。趁热过滤的目的是__________;
晶体的操作:先将混合溶液蒸发浓缩,趁热过滤。然后将滤液冷却结晶,从而析出红矾钠。趁热过滤的目的是__________;
(3)含![]() 的废水要经过化学处理,使
的废水要经过化学处理,使![]() 降到
降到![]() 以下才能排放,用沉淀法处理该废液是方法之一。
以下才能排放,用沉淀法处理该废液是方法之一。
已知:![]() ,则
,则![]() 至少应达到__________。
至少应达到__________。
(4)用重铬酸钾测定铁矿石中铁的含量,实验步骤如下:
步骤1:将![]() 铁矿石加浓盐酸加热溶解
铁矿石加浓盐酸加热溶解
步骤2:加入![]() 溶液将
溶液将![]() 还原
还原
步骤3:将所得溶液冷却,加入![]() 溶液,将过量的
溶液,将过量的![]() 氧化为
氧化为![]()
步骤4:加入![]() 硫酸和磷酸的混合酸及5滴0.2%二苯胺磺酸钠指示剂
硫酸和磷酸的混合酸及5滴0.2%二苯胺磺酸钠指示剂
步骤5:立即用![]() 重铬酸钾溶液滴定至溶液呈稳定紫色,即为终点,消耗重铬酸钾溶液
重铬酸钾溶液滴定至溶液呈稳定紫色,即为终点,消耗重铬酸钾溶液![]() (已知:
(已知:![]() )
)
①写出![]() 还原
还原![]() 的离子方程式______________________________。
的离子方程式______________________________。
②求![]() 铁矿石中含铁元素的质量(用含字母
铁矿石中含铁元素的质量(用含字母![]() 、
、![]() 的代数式表示)__________。
的代数式表示)__________。
③如省去步骤③,则所测定的铁的含量__________(填“偏高”、“偏低”或“无影响”)。
④步骤5使用的玻璃仪器有____________________。
查看习题详情和答案>>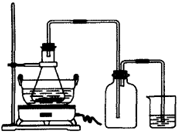 绿矾(FeSO4?7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.
绿矾(FeSO4?7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.请回答下列问题:
(1)图是某研究性学习小组用于制备绿矾的装置,其中集气瓶的作用是
(2)如图锥形瓶中的反应物是铁屑和28%的硫酸,反应前常用98%的硫酸配制500g 28%的硫酸,要算出所需98%的硫酸的体积,还要知道的数据是
(3)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化.设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤同,制得硫酸亚铁,并对产品质量进行检测.检测结果如下:
| 序号 | 反应物用量 | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于Ⅰ级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于Ⅰ级 |
(4)该小组在继续研究由绿矾制备Fe(OH)2的过程中,发现出现白色的沉淀会逐渐转变为灰绿色,最后变为红褐色.甲同学查资料该灰绿色沉淀可能是Fe3(OH)8,请用氧化物的形式写出该沉淀