摘要: 答案:(1) ②水解反应,消去反应 ③ 或 ④
网址:http://m.1010jiajiao.com/timu3_id_65563[举报]
下列结果是马虎同学回答同桌提问的答案,你认为需要改正的是( )
①微粒半径:S2->Cl->K+
②氢化物稳定性:HCl>H2S>PH3
③还原性:Na>Mg>K
④氧化性:Cl2>S>F2
⑤酸性:H2SO4>HClO4>H2SiO3
⑥得电子能力:F>Cl>Br.
①微粒半径:S2->Cl->K+
②氢化物稳定性:HCl>H2S>PH3
③还原性:Na>Mg>K
④氧化性:Cl2>S>F2
⑤酸性:H2SO4>HClO4>H2SiO3
⑥得电子能力:F>Cl>Br.
查看习题详情和答案>>
(2011?闵行区二模)环己烯可以通过丁二烯与乙烯发生环化加成反应得到:

实验证明,下列反应中反应物分子的环外双键比环内双键更容易被氧化:

现仅以丁二烯为有机原料,无机试剂任选,按下列途径合成一系列物质:

已知E能使紫色石蕊溶液变红,且能使酸性高酸钾溶液褪色,请按要求填空:
(1)上述途径中属于加成反应的是
(2)A的结构简式是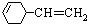
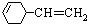 ;它的一氯代物的结构有
;它的一氯代物的结构有
(3)写出反应④的化学方程式
 .
.
(4)
不能发生的化学反应有
a.取代反应; b.加成反应; c.消去反应; d.酯化反应;
e.水解反应; f.氧化反应.
查看习题详情和答案>>

实验证明,下列反应中反应物分子的环外双键比环内双键更容易被氧化:

现仅以丁二烯为有机原料,无机试剂任选,按下列途径合成一系列物质:

已知E能使紫色石蕊溶液变红,且能使酸性高酸钾溶液褪色,请按要求填空:
(1)上述途径中属于加成反应的是
①③⑤
①③⑤
(填反应序号).(2)A的结构简式是
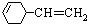
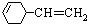
8
8
.(3)写出反应④的化学方程式


(4)

不能发生的化学反应有
cd
cd
(填答案编号).a.取代反应; b.加成反应; c.消去反应; d.酯化反应;
e.水解反应; f.氧化反应.
本题分两个题目.
Ⅰ、影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题.

(1)现设计如下实验方案探究温度和c(H2SO4)对锌与稀硫酸反应速率的影响.
①请在表格空白处填写适当的反应条件.
(注:在实验Ⅰ、Ⅱ、Ⅲ中,锌粒表面积相同)
②“需测量的数据”是
(2)对于实验Ⅰ,锌粒与H2SO4反应生成H2的量与反应时间的关系曲线如图2所示.请在图3中画出上述反应的速率(mL/min)与时间(min)的关系曲线图.
Ⅱ、在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸.在不同情况下可能有以下关系:
A.b>a>c B.b>a=c C.c>a>b D.c>a=b E.a=b>c
请从上述选项中选择合适的答案.
(3)当三种酸溶液pH相同时,三者物质的量浓度关系顺序是
(4)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是
(5)当三者c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),反应所需时间的长短关系是
(6)将pH相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是
查看习题详情和答案>>
Ⅰ、影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题.

(1)现设计如下实验方案探究温度和c(H2SO4)对锌与稀硫酸反应速率的影响.
①请在表格空白处填写适当的反应条件.
| 编号 | 实验目的 | 锌粒 | 温度 | c(H2SO4) | 需测量的数据 |
| Ⅰ | 为以下实验作参照 | 3粒 | 25℃ | c1 | a |
| Ⅱ | 探究温度对反应速率的影响 | 3粒 | 50℃ | c1 c1 |
b |
| Ⅲ | 探究浓度对反应速率的影响 | 3粒 | 25℃ 25℃ |
c2 | d |
②“需测量的数据”是
一定时间内收集到的气体体积或收集一定体积的气体所需要的时间
一定时间内收集到的气体体积或收集一定体积的气体所需要的时间
.(2)对于实验Ⅰ,锌粒与H2SO4反应生成H2的量与反应时间的关系曲线如图2所示.请在图3中画出上述反应的速率(mL/min)与时间(min)的关系曲线图.
Ⅱ、在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸.在不同情况下可能有以下关系:
A.b>a>c B.b>a=c C.c>a>b D.c>a=b E.a=b>c
请从上述选项中选择合适的答案.
(3)当三种酸溶液pH相同时,三者物质的量浓度关系顺序是
C
C
.(4)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是
B
B
.(5)当三者c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),反应所需时间的长短关系是
D
D
(认为H2SO4第二步电离完全,并忽略阴离子对反应速率的影响).(6)将pH相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是
D
D
.(2013?武昌区模拟)全世界每年被腐蚀损耗的钢铁量非常惊人,在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因.
(1)在潮湿空气中,钢铁发生吸氧腐蚀时的负极反应的电极反应式为
(2)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4
CO↑+CO2↑+H2O,下列装置中,可用作草酸分解制取气体的是

(3)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3?nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示.

①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的液态试剂依次可能是
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液 d.无水氯化钙
②在点燃C处酒精灯之前应进行的操作是:(a)检查装置气密性;(b)
③E装置的作用是
④准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n=
⑤在本实验中,下列情况会使测定结果n偏大的是
a.缺少装置B b.缺少装置E c.反应后的固体中有少量Fe2O3?nH2O.
查看习题详情和答案>>
(1)在潮湿空气中,钢铁发生吸氧腐蚀时的负极反应的电极反应式为
Fe-2e-=Fe2+
Fe-2e-=Fe2+
.(2)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4
| 浓硫酸 | 加热 |
d
d
(填答案编号).
(3)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3?nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示.

①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的液态试剂依次可能是
c
c
、a
a
(填答案编号).a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液 d.无水氯化钙
②在点燃C处酒精灯之前应进行的操作是:(a)检查装置气密性;(b)
通入混合气体一段时间,排除体系中的空气,防止加热时CO发生爆炸
通入混合气体一段时间,排除体系中的空气,防止加热时CO发生爆炸
.③E装置的作用是
防止空气中的CO2和H2O进入体系,影响实验结果
防止空气中的CO2和H2O进入体系,影响实验结果
,上述装置最后尾气处理的方法是点燃
点燃
.④准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n=
2
2
.⑤在本实验中,下列情况会使测定结果n偏大的是
a
a
(填答案编号).a.缺少装置B b.缺少装置E c.反应后的固体中有少量Fe2O3?nH2O.
全世界每年被腐蚀损耗的钢铁量非常惊人,在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因。
(1)在潮湿空气中,钢铁发生吸氧腐蚀时的负极反应的电极反应式为 。
(2)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4 CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是 (填答案编号)。
CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是 (填答案编号)。

(3)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3·nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。

①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的液态试剂依次可能是 、 (填答案编号)。
a. 浓硫酸 b.澄清的石灰水 c. 氢氧化钠溶液 d. 无水氯化钙
②E装置的作用是 ,
上述装置最后尾气处理的方法是 。
③准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32 g,D中浓硫酸增重0.72 g,则n = 。
④在本实验中,下列情况会使测定结果n偏大的是 (填答案编号)。
a.缺少装置B b.缺少装置E c.反应后的固体中有少量Fe2O3·nH2O
查看习题详情和答案>>