题目内容
本题分两个题目.
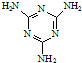
Ⅰ、影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题.

(1)现设计如下实验方案探究温度和c(H2SO4)对锌与稀硫酸反应速率的影响.
①请在表格空白处填写适当的反应条件.
(注:在实验Ⅰ、Ⅱ、Ⅲ中,锌粒表面积相同)
②“需测量的数据”是
(2)对于实验Ⅰ,锌粒与H2SO4反应生成H2的量与反应时间的关系曲线如图2所示.请在图3中画出上述反应的速率(mL/min)与时间(min)的关系曲线图.
Ⅱ、在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸.在不同情况下可能有以下关系:
A.b>a>c B.b>a=c C.c>a>b D.c>a=b E.a=b>c
请从上述选项中选择合适的答案.
(3)当三种酸溶液pH相同时,三者物质的量浓度关系顺序是
(4)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是
(5)当三者c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),反应所需时间的长短关系是
(6)将pH相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是
Ⅰ、影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题.

(1)现设计如下实验方案探究温度和c(H2SO4)对锌与稀硫酸反应速率的影响.
①请在表格空白处填写适当的反应条件.
| 编号 | 实验目的 | 锌粒 | 温度 | c(H2SO4) | 需测量的数据 |
| Ⅰ | 为以下实验作参照 | 3粒 | 25℃ | c1 | a |
| Ⅱ | 探究温度对反应速率的影响 | 3粒 | 50℃ | c1 c1 |
b |
| Ⅲ | 探究浓度对反应速率的影响 | 3粒 | 25℃ 25℃ |
c2 | d |
②“需测量的数据”是
一定时间内收集到的气体体积或收集一定体积的气体所需要的时间
一定时间内收集到的气体体积或收集一定体积的气体所需要的时间
.(2)对于实验Ⅰ,锌粒与H2SO4反应生成H2的量与反应时间的关系曲线如图2所示.请在图3中画出上述反应的速率(mL/min)与时间(min)的关系曲线图.
Ⅱ、在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸.在不同情况下可能有以下关系:
A.b>a>c B.b>a=c C.c>a>b D.c>a=b E.a=b>c
请从上述选项中选择合适的答案.
(3)当三种酸溶液pH相同时,三者物质的量浓度关系顺序是
C
C
.(4)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是
B
B
.(5)当三者c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),反应所需时间的长短关系是
D
D
(认为H2SO4第二步电离完全,并忽略阴离子对反应速率的影响).(6)将pH相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是
D
D
.分析:(1)①Ⅱ探究温度对反应速率的影响,其他条件相同,温度应该不同;
Ⅲ探究浓度对反应速率的影响,应该除了浓度外其他条件相同;
②需测量一定时间内收集到的气体体积或收集一定体积的气体所需要的时间,通过比较判断浓度、温度对反应速率的影响;
盐酸、硫酸是强电解质,溶液中氢离子完全电离出来;醋酸是弱电解质,部分电离,
(3)醋酸浓度最大,硫酸是二元酸,与盐酸氢离子浓度相等,硫酸物质的量浓度要小于盐酸的;
(4)根据硫酸是二元酸,含有的氢离子浓度增大进行分析;
(5)溶液中氢离子浓度越大,反应速率越快,产生相同体积的H2(相同状况)所需时间越短;
(6)强酸溶液稀释10倍,氢离子浓度变为原来的0.1倍,弱酸溶液稀释10倍,氢离子浓度变为大于原来的0.1倍.
Ⅲ探究浓度对反应速率的影响,应该除了浓度外其他条件相同;
②需测量一定时间内收集到的气体体积或收集一定体积的气体所需要的时间,通过比较判断浓度、温度对反应速率的影响;
盐酸、硫酸是强电解质,溶液中氢离子完全电离出来;醋酸是弱电解质,部分电离,
(3)醋酸浓度最大,硫酸是二元酸,与盐酸氢离子浓度相等,硫酸物质的量浓度要小于盐酸的;
(4)根据硫酸是二元酸,含有的氢离子浓度增大进行分析;
(5)溶液中氢离子浓度越大,反应速率越快,产生相同体积的H2(相同状况)所需时间越短;
(6)强酸溶液稀释10倍,氢离子浓度变为原来的0.1倍,弱酸溶液稀释10倍,氢离子浓度变为大于原来的0.1倍.
解答:解:(1)①Ⅱ由于探究温度对反应速率的影响,其他条件相同,温度应该不同,
故答案为:c1;
Ⅲ由于探究浓度对反应速率的影响,应该除了浓度外其他条件相同,
故答案为:25℃;
②锌与稀硫酸反应,通过测定一定时间内收集到的气体体积或收集一定体积的气体所需要的时间,判断温度、浓度都反应速率的影响,
故答案为:一定时间内收集到的气体体积或收集一定体积的气体所需要的时间;
由于盐酸、硫酸是强电解质,溶液中氢离子完全电离出来;醋酸是弱电解质,部分电离,
(3)醋酸浓度大于溶液中氢离子浓度,所以醋酸浓度最大,硫酸是二元酸,与盐酸溶液中氢离子浓度相等,硫酸物质的量浓度要小于盐酸的浓度,所以c>a>b,
故选C;
(4)由于硫酸是二元酸,同体积、同物质的量浓度时,硫酸溶液中的氢离子浓度增大,中和的氢氧化钠溶液体积增大;醋酸和盐酸都是一元酸,消耗的氢氧化钠的物质的量相等,所以b>a=c,
故选B;
(5)由于溶液中氢离子浓度越大,反应速率越快,产生相同体积的H2(相同状况)所需时间越短;醋酸是弱电解质,随着氢离子消耗,电离程度增大,反应速率最快,而盐酸、硫酸都是强电解质,氢离子物质的量固定,所以二者反应速率相同,所以c>a=b,
故选D;
(6)强酸溶液稀释10倍,氢离子浓度变为原来的0.1倍,弱酸溶液稀释10倍,氢离子浓度变为大于原来的0.1倍,盐酸和硫酸是强酸,醋酸是弱酸,所以c(H+)由大到小的顺序为c>a=b,
故选D.
故答案为:c1;
Ⅲ由于探究浓度对反应速率的影响,应该除了浓度外其他条件相同,
故答案为:25℃;
②锌与稀硫酸反应,通过测定一定时间内收集到的气体体积或收集一定体积的气体所需要的时间,判断温度、浓度都反应速率的影响,
故答案为:一定时间内收集到的气体体积或收集一定体积的气体所需要的时间;
由于盐酸、硫酸是强电解质,溶液中氢离子完全电离出来;醋酸是弱电解质,部分电离,
(3)醋酸浓度大于溶液中氢离子浓度,所以醋酸浓度最大,硫酸是二元酸,与盐酸溶液中氢离子浓度相等,硫酸物质的量浓度要小于盐酸的浓度,所以c>a>b,
故选C;
(4)由于硫酸是二元酸,同体积、同物质的量浓度时,硫酸溶液中的氢离子浓度增大,中和的氢氧化钠溶液体积增大;醋酸和盐酸都是一元酸,消耗的氢氧化钠的物质的量相等,所以b>a=c,
故选B;
(5)由于溶液中氢离子浓度越大,反应速率越快,产生相同体积的H2(相同状况)所需时间越短;醋酸是弱电解质,随着氢离子消耗,电离程度增大,反应速率最快,而盐酸、硫酸都是强电解质,氢离子物质的量固定,所以二者反应速率相同,所以c>a=b,
故选D;
(6)强酸溶液稀释10倍,氢离子浓度变为原来的0.1倍,弱酸溶液稀释10倍,氢离子浓度变为大于原来的0.1倍,盐酸和硫酸是强酸,醋酸是弱酸,所以c(H+)由大到小的顺序为c>a=b,
故选D.
点评:本题考查了探究影响反应速率的因素及弱电解质的电离及溶液中离子浓度大小的比较,根据电解质的强弱及酸的元数来分析解答即可,难度较大,注意弱电解质稀释时溶液中各种离子浓度的变化,为易错点.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
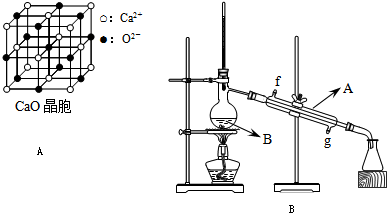

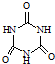
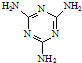 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸( 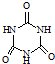 )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过