网址:http://m.1010jiajiao.com/timu3_id_65354[举报]
(2)一定条件下,0.1mol氨气与氧气反应生成两种无毒气体,放出31.67kJ热量.写出核反应的热化学方程式:
(3)现有固体X,可能含有Cu、SiO2、KNO3、NH4Cl中的一种或几种.为了探究其成分,某学习小组取该样品进行如图1实验(部分产物已略去).
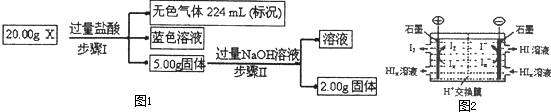
①步骤I中发生反应的离子方程式为
②20.00gX中Cu的质量分数为
③为进一步确定固体X的组成,常温下,学习小组另取固体X加水,充分搅拌后过滤,测得滤液的pH<7.他们判断一定有NH4Cl,理由是
(4)工业上常用电渗析法生产HI,其模拟实验如图2.写出阴极的电极反应式:
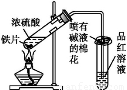
某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。
 ????????????????????????
???????????????????????? 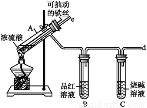
图1 ????????????????????????????????? 图2
(1)比较两实验装置,图2装置的优点是:
①能更好地吸收有毒气体SO2,防止其污染环境;
② 。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而污染环境;二是 。
(3)能说明有SO2气体产生的实验现象是 。
(4)反应一段时间后,用滴管吸取A试管中的溶液滴入适量水中为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
为验证Ⅱ、Ⅲ的可能性,选用如下试剂,填写下列空格:
A.稀HCl溶液B.稀H2SO4溶液???? C.KSCN溶液D.KMnO4溶液
E.NaOH溶液F.淀粉KI溶液???? G.H2O2溶液
验证Ⅱ:取试样,先滴加少量的 (填试剂序号,下同),振荡,再滴加少量的 ,根据溶液颜色的变化可确定假设Ⅱ是否正确。反应的离子方程式是 ,Fe3++3SCN- Fe(SCN)3。
Fe(SCN)3。
验证Ⅲ:步骤1.取试样,滴加少量的 (填试剂序号),溶液的颜色变 色,则试样中含有Fe3+。
步骤2.再取适量的试样滴加到少量的 (填试剂序号),观察到的现象为 ,则试样中含有Fe2+。
查看习题详情和答案>>

图2-4
(1)写出步骤③发生的全部反应的离子方程式。
(2)若Y和Z充分反应,生成的不溶物的质量是m,则每份试样X中氧化铜为多少克?(用m表示)
查看习题详情和答案>>在图2—10甲、乙、丙、丁四个装置中,A、B为未充气气球,C为玻璃导管,D为胶头滴管。实验时把胶头滴管里的溶液(足量)加入锥形瓶中,并轻轻震荡。
(1)(8分)实验过程中可观察到气球的变化:
甲__________________________;乙_________________________;
丙__________________________;丁_________________________。
(2)(8分)用化学方程式表示所发生的化学反应?
甲______________________________,乙_________________________,
丙_____________________________, 丁__________________________.
(3)(6分)反应前后整个装置的质量变化(填“增大”“减小”或“不变”等)?
甲 ,乙 ,丙 ,丁 。
查看习题详情和答案>>
(13分)某校化学兴趣小组为探究铁与浓硫酸的反应,设计了图1、图2所示装置进行实验。
(1)比较两个实验装置,图2装置的优点是:
①能更好的吸收有毒气体SO2防止其污染环境;
② 。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到”液封”作用阻止SO2气体逸出而防止污染环境;二是 。
(3)能说明有SO2气体产生的实验现象是 。
(4)反应一段时间后,用滴管吸取A试管中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
为验证Ⅱ、Ⅲ的可能性,选用如下试剂,填写下列空格:
| A.稀HCl溶液 | B.稀硫酸 | C.KSCN溶液 | D.酸性KMnO4溶液 |
验证Ⅱ:取试样,先滴加少量的 (填试剂序号,下同),振荡,再滴加少量的 ,根据溶液颜色的变化可确定假设Ⅱ是否正确。
验证Ⅲ:步骤1.取试样,滴加少量的 (填试剂序号),溶液的颜色变 色,则试样中含有Fe3+发生反应的离子方程式为 。
步骤2.再取适量的试样滴加少量的 (填试剂序号),溶液颜色的变化为 ,则试样中含有Fe2+。 查看习题详情和答案>>