网址:http://m.1010jiajiao.com/timu3_id_64805[举报]
在21℃和充分搅拌下,将不同体积1.0 mol·L—1 HCl溶液和未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下:
| 盐酸的体积V(mL) | 5.0 | 10.0 | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 | 40.0 | 45.0 |
| NaOH的体积(mL) | 45.0 | 40.0 | 35.0 | 30.0 | 25.0 | 20.0 | 15.0 | 10.0 | 5.0 |
| 溶液温度t(℃) | 22.2 | 23.3 | 24.6 | 25.8 | 27.0 | 27.8 | 26.1 | 24.4 | 22.8 |
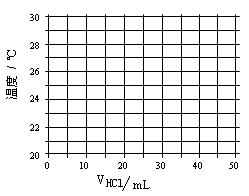 (1)在给定的坐标图上绘出溶液温度与盐酸体积的关系图。
(1)在给定的坐标图上绘出溶液温度与盐酸体积的关系图。
(2)假定酸碱恰好完全反应前后,溶液温度与盐酸体积可以近似
地认为呈线性关系。请写出溶液温度t与盐酸体积V的线性
关系式(请用含有t和V的式子表示) 、 。
(3)所用NaOH溶液的物质的量浓度= 。
备用 . 四氧化三铅俗名“铅丹”或“红丹”,由于有氧化性被大量地用于油漆船舶和桥梁钢架防锈,其化学式可写为2PbO·PbO2。欲测定某样品中四氧化三铅含量,进行如下操作:
①称取样品0.1000g,加酸溶解,得到含Pb2+的溶液。
②在加热条件下用过量K2Cr2O7将Pb2+沉淀为PbCrO4,冷却后过滤洗涤沉淀。
③将PbCrO4沉淀用酸溶液溶解(沉淀溶解的离子方程式为:2PbCrO4+2H+=
2Pb2+Cr2O72-+H2O),加入过量KI,再用0.1000mol·L―1 Na2S2O3溶液滴定,到滴定终点时用
去12.00mL(滴定过程中离子方程式为:I2+2S2O32-=2I-+S4O62-)。
则:(1)写出步骤③中加入过量KI后溶液中发生的离子反应方程式 。
(2)用标准溶液滴定时所用的指示剂是 。(写试剂名称)
(3)计算试样中Pb3O4的质量分数。(Pb的相对原子质量为207.2)
查看习题详情和答案>>
在21℃和充分搅拌下,将不同体积1.0 mol·L—1 HCl溶液和未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下:
| 盐酸的体积V(mL) | 5.0 | 10.0 | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 | 40.0 | 45.0 |
| NaOH的体积(mL) | 45.0 | 40.0 | 35.0 | 30.0 | 25.0 | 20.0 | 15.0 | 10.0 | 5.0 |
| 溶液温度t(℃) | 22.2 | 23.3 | 24.6 | 25.8 | 27.0 | 27.8 | 26.1 | 24.4 | 22.8 |
(1)在给定的坐标图上绘出溶液温度与盐酸体积的关系图。
(2)假定酸碱恰好完全反应前后,溶液温度与盐酸体积可以近似
地认为呈线性关系。请写出溶液温度t与盐酸体积V的线性
关系式(请用含有t和V的式子表示) 、 。
(3)所用NaOH溶液的物质的量浓度= 。
备用 . 四氧化三铅俗名“铅丹”或“红丹”,由于有氧化性被大量地用于油漆船舶和桥梁钢架防锈,其化学式可写为2PbO·PbO2。欲测定某样品中四氧化三铅含量,进行如下操作:
①称取样品0.1000g,加酸溶解,得到含Pb2+的溶液。
②在加热条件下用过量K2Cr2O7将Pb2+沉淀为PbCrO4,冷却后过滤洗涤沉淀。
③将PbCrO4沉淀用酸溶液溶解(沉淀溶解的离子方程式为:2PbCrO4+2H+=
2Pb2+Cr2O72-+H2O),加入过量KI,再用0.1000mol·L―1 Na2S2O3溶液滴定,到滴定终点时用
去12.00mL(滴定过程中离子方程式为:I2+2S2O32-=2I-+S4O62-)。
则:(1)写出步骤③中加入过量KI后溶液中发生的离子反应方程式 。
(2)用标准溶液滴定时所用的指示剂是 。(写试剂名称)
(3)计算试样中Pb3O4的质量分数。(Pb的相对原子质量为207.2)
按要求回答下列问题
(1)用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是________(填序号)
①碱式滴定管用蒸馏水洗净后没有用标准液润洗
②用酸式滴定管加待测液时,刚用蒸馏水洗净后的滴定管未用待测液润洗
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④滴定前滴定管尖端有气泡,滴定后气泡消失
⑤终点读数时俯视,其他读数方法正确
(2)某课外活动小组同学用右图甲装置进行实验,试答下列问题:
①若开始时开关K与a连接,则铁发生电化学腐蚀中的________腐蚀.
②若开始时开关K与b连接,则总反应的离子方程式为________.
(3)已知:铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O
2PbSO4+2H2O
①铅蓄电池在放电时负极反应为________,
②铅蓄电池在充电时阳极反应为________;
③如果铅蓄电池在放电时回路中有2 mol电子转移时,消耗H2SO4________mol.
(4)常温下,如果取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,求出混合液中下列算式的精确计算结果(填具体数字):c(OH-)-c(HA)=________mol/L.
(5)在Cl-、Al3+、HSO4-、K+、HS-五种离子中,只能水解不能电离的离子是________,只能电离不能水解的离子是________,既能电离又能水解的离子是________,写出能水解离子的水解离子方程式________,________.
(6)已知25℃时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,测得某溶液的pH=13,则此温度下溶液中的c(Mg2+)=________.
(12分)按要求回答下列问题
(1)用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是 (填序号 )
①碱式滴定管用蒸馏水洗净后没有用标准液润洗
②锥形瓶用蒸馏水洗净后没有用待测液润洗
③用酸式滴定管加待测液时,刚用蒸馏水洗净后的滴定管未用待测液润洗
④滴定前滴定管尖端有气泡,滴定后气泡消失
⑤终点读数时俯视,其他读数方法正确
(2)某课外活动小组同学用右图甲装置进行实验,试答下列问题: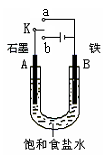
①若开始时开关K与a连接,则铁发生电化学腐蚀中的 腐蚀。
②若开始时开关K与b连接,则总反应的离子方程式为 。
(3)常温下,如果取0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,求出混合液中下列算式的精确计算结果(填具体数字):c(OH-)-c(HA)= ___________ mol/L。
(4)在Cl-、Al3+、HSO4-、K+、HS-五种离子中,只能水解不能电离的离子是 ,只能电离不能水解的离子是 ,既能电离又能水解的离子是 ,写出能水解离子的水解离子方程式 , 。
(5)已知25℃时,Mg(OH)2的溶度积常数Ksp = 5.6×10-12,测得某溶液的pH = 13,则此温度下溶液中的c(Mg2+) = ____________________。
(18分)按要求回答下列问题
(1)用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是 (填序号 )
①碱式滴定管用蒸馏水洗净后没有用标准液润洗
②用酸式滴定管加待测液时,刚用蒸馏水洗净后的滴定管未用待测液润洗
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④滴定前滴定管尖端有气泡,滴定后气泡消失
⑤终点读数时俯视,其他读数方法正确
(2)某课外活动小组同学用如图甲装置进行实验,试答下列问题:
①若开始时开关K与a连接,则铁发生电化学腐蚀中的 腐蚀。
②若开始时开关K与b连接,则总反应的离子方程式为 。
(3)已知:铅蓄电池总的化学方程式为:Pb+PbO2 +2H2SO4 2PbSO4+2H2O
2PbSO4+2H2O
①铅蓄电池在放电时负极反应为 ,
②铅蓄电池在充电时阳极反应为 ;
③如果铅蓄电池在放电时回路中有2mol电子转移时,消耗H2SO4 mol。
(4)常温下,如果取0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,求出混合液中下列算式的精确计算结果(填具体数字):
c(OH-)-c(HA)= ___________ mol/L。
(5)在Cl-、Al3+、HSO4-、K+、HS-五种离子中,只能水解不能电离的离子是 ,只能电离不能水解的离子是 ,既能电离又能水解的离子是 ,写出能水解离子的水解离子方程式 , 。
(6)已知25℃时,Mg(OH)2的溶度积常数Ksp = 5.6×10-12,测得某溶液的pH = 13,则此温度下溶液中的c(Mg2+) = ____________________。