题目内容
在21℃和充分搅拌下,将不同体积1.0 mol·L—1 HCl溶液和未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下:
| 盐酸的体积V(mL) | 5.0 | 10.0 | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 | 40.0 | 45.0 |
| NaOH的体积(mL) | 45.0 | 40.0 | 35.0 | 30.0 | 25.0 | 20.0 | 15.0 | 10.0 | 5.0 |
| 溶液温度t(℃) | 22.2 | 23.3 | 24.6 | 25.8 | 27.0 | 27.8 | 26.1 | 24.4 | 22.8 |
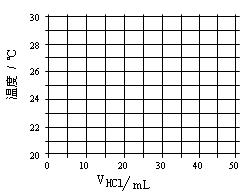 (1)在给定的坐标图上绘出溶液温度与盐酸体积的关系图。
(1)在给定的坐标图上绘出溶液温度与盐酸体积的关系图。
(2)假定酸碱恰好完全反应前后,溶液温度与盐酸体积可以近似
地认为呈线性关系。请写出溶液温度t与盐酸体积V的线性
关系式(请用含有t和V的式子表示) 、 。
(3)所用NaOH溶液的物质的量浓度= 。
备用 . 四氧化三铅俗名“铅丹”或“红丹”,由于有氧化性被大量地用于油漆船舶和桥梁钢架防锈,其化学式可写为2PbO·PbO2。欲测定某样品中四氧化三铅含量,进行如下操作:
①称取样品0.1000g,加酸溶解,得到含Pb2+的溶液。
②在加热条件下用过量K2Cr2O7将Pb2+沉淀为PbCrO4,冷却后过滤洗涤沉淀。
③将PbCrO4沉淀用酸溶液溶解(沉淀溶解的离子方程式为:2PbCrO4+2H+=
2Pb2+Cr2O72-+H2O),加入过量KI,再用0.1000mol·L―1 Na2S2O3溶液滴定,到滴定终点时用
去12.00mL(滴定过程中离子方程式为:I2+2S2O32-=2I-+S4O62-)。
则:(1)写出步骤③中加入过量KI后溶液中发生的离子反应方程式 。
(2)用标准溶液滴定时所用的指示剂是 。(写试剂名称)
(3)计算试样中Pb3O4的质量分数。(Pb的相对原子质量为207.2)
(1) Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O
(2)淀粉 (3)91.41%
解析:
(2)根据碘单质能使淀粉变蓝的特性做此选择。
(3)Pb3O4~3Pb2+~3/2Cr2O72-~3×3/2I2~3×3/2×2S2O32-
685.6 9
x g 0.1000mol·L―1×12.00mL×10―3 L·mL―1
x=0.09141 g Pb3O4%=91.41%

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案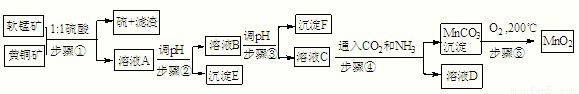
步骤①:5MnO2+2CuFeS2+10H2SO4=5MnSO4+Fe2(SO4)3+2CuSO4+4S+10H2O
(1)请写出MnO2一种用途:______.
根据下表数据,回答相关问题.
| Cu(OH)2 | Fe(OH)3 | Mn(OH)2 | Fe(OH)2 | |
| 开始沉淀pH | 4.2 | 1.5 | 7.3 | 6.4 |
| 完全沉淀pH | 6.7 | 3.2 | 9.8 | 9.0 |
(3)若c(MnSO4)=3×10-6 mol?L-1,c(CO32-)=3.3×10-5 mol?L-1,则MnSO4溶液与碳酸盐溶液按体积比2:1混合,恰好达到溶解平衡,MnCO3的Ksp=______.
(4)请写出步骤④发生的离子反应方程式:______.
(5)步骤⑤,在不同温度下分解可得到锰的不同氧化物.根据如图数据计算:530℃至1000℃时,可得一种固体纯净物.其化学式为:______.
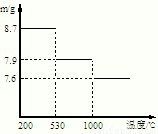
(6)称取0.435g软锰矿于烧杯中,再分别往烧杯中加入过量的20.00mL 0.1000mol?L-1 Na2C2O4溶液和过量的硫酸,充分搅拌溶解,过滤,将滤液转移至锥形瓶中,用0.1000mol?L-1的KMnO4溶液滴定至终点,消耗了4.00mL KMnO4的溶液.反应式如下:MnO2+Na2C2O4+2H2SO4=MnSO4+Na2SO4+2CO2↑+2H2O
①写出酸性KMnO4溶液滴定剩余Na2C2O4溶液的离子反应方程式:______.
②计算软锰矿中MnO2的百分含量______.