摘要:(1)Al2O3 + 6H+ = 2Al3++3H2O (2)SiO2 + 2OH-= SiO32 -+ H2O (3)硫氰化钾(或硫氰酸钾.苯酚溶液等合理答案) (4)NaHCO3,制纯碱或做发酵粉等合理答案. (5)5.6×10-10mol/L
网址:http://m.1010jiajiao.com/timu3_id_64391[举报]
元素周期表是学习化学的重要工具,它隐含许多信息和规律.
(1)以下为元素周期表的一部分,写出表中c、d的元素符号:c
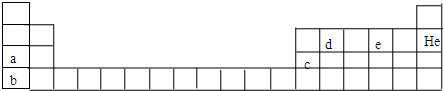
(2)用元素符号标出硫在周期表中对应的位置.
(3)相同大小的a、b两种元素的单质分别投入热坩埚中,反应较剧烈的是
(4)写出c的氧化物与硫酸反应的离子方程式:
b元素的单质与e的氢化物(分子中含三个原子核)反应的化学方程式为
查看习题详情和答案>>
(1)以下为元素周期表的一部分,写出表中c、d的元素符号:c
Al
Al
dC
C

(2)用元素符号标出硫在周期表中对应的位置.
(3)相同大小的a、b两种元素的单质分别投入热坩埚中,反应较剧烈的是
K
K
(用化学式表示,下同).(4)写出c的氧化物与硫酸反应的离子方程式:
Al2O3+6H+═2Al3++3H2O
Al2O3+6H+═2Al3++3H2O
.b元素的单质与e的氢化物(分子中含三个原子核)反应的化学方程式为
2K+2H2O═2KOH+H2↑
2K+2H2O═2KOH+H2↑
.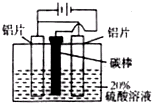 (2013?德州一模)I.铝的阳极氧化能使铝的表面生成一层特别致密的氧化膜,该氧化膜不溶于稀硫 酸,模拟该生产过程如下:
(2013?德州一模)I.铝的阳极氧化能使铝的表面生成一层特别致密的氧化膜,该氧化膜不溶于稀硫 酸,模拟该生产过程如下:(1)把铝片浸入热的16%NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗.写出除去氧化膜有关反应的 离子方程式
Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-=2AlO2-+H2O
(2)如图,组装好仪器,通电约25min.在阳极生成氧化铝,阴极产生气体.则该过程中阳极发生反应的电极式为
2Al+3H2O-6e-=Al2O3+6H+
2Al+3H2O-6e-=Al2O3+6H+
;该溶液PH的变化减小
减小
(填:“增大”或“减小”或“不变”)II 现代社会对电池的需求越来越大,尤其足可充电的二次电池.
髙铁电池是一种新型可充电电池,总反应为:3Zn(OH)2+2Fe(OH)3+4KOH
| 充电 | 放电 |
K2FeO4
K2FeO4
其电极反应式是FeO42-+4H2O+3e-=Fe(OH)3+5OH-
FeO42-+4H2O+3e-=Fe(OH)3+5OH-
,若电路中通过1.204X 1O23个电子时,负极质量变化为6.5
6.5
g充电时,该电池的正极接直流电源的正极
正极
(填“正极”或“负极”).A、B、C、D是同一周期的4种元素,A、B、C的原子序数依次相差为1,A元素的单质化学性质活泼.A元素原子半径在本周期中最大.2.00g B元素的氧化物恰好和100mL 0.50mol?L-1稀硫酸完全反应.B元素的单质跟D元素单质反应生成化合物BD2.试回答:
(1)写出A、B、C、D 4种元素最高价氧化物对应水化物的化学式,并按碱性逐渐减弱,酸性逐渐增强的顺序加以排列:
(2)写出下列反应的离子方程式:
①将C的氧化物投入到A的氧化物的水化物中:
②将C的氧化物投入到D的氢化物的水溶液中:
(3)B的单质投入沸水中反应的化学方程式:
查看习题详情和答案>>
(1)写出A、B、C、D 4种元素最高价氧化物对应水化物的化学式,并按碱性逐渐减弱,酸性逐渐增强的顺序加以排列:
NaOH、Mg(OH)2、Al(OH)3、HClO4
NaOH、Mg(OH)2、Al(OH)3、HClO4
.(2)写出下列反应的离子方程式:
①将C的氧化物投入到A的氧化物的水化物中:
Al2O3+2OH-═2AlO2-+H2O
Al2O3+2OH-═2AlO2-+H2O
.②将C的氧化物投入到D的氢化物的水溶液中:
Al2O3+6H+═2Al3++3H2O
Al2O3+6H+═2Al3++3H2O
.(3)B的单质投入沸水中反应的化学方程式:
Mg+H2O(沸水)═Mg(OH)2+H2↑
Mg+H2O(沸水)═Mg(OH)2+H2↑
.聚合铝(PAC)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.用铝灰、铝土矿、铝渣等为原料(主要成分为Al、Al2O3)可制取聚合铝.实验步骤如图:

(1)写出铝、氧化铝分别与盐酸反应的离子方程式:
(2)用36.5%的盐酸配制20%的盐酸,操作步骤是
(3)聚合铝(PAC)的分子式为[Al2(OH)aClb]m,聚合铝中OH-与Al3+的比值对净水效果有很大影响,定义盐基度B=n(OH-)/3n(Al3+),当B=2/3时,b=
(4)聚合过程主要利用了Al3+的性质是
(5)要测定1mol聚合铝中a的值.
①测定时所需的试剂是
(a) NaOH(b)AgNO3(c) pH试纸(d) HNO3
②需要直接测定的物理量是
③测定过程中所需的基本操作是
(a) 洗涤(b) 过滤(c) 称量 (d) 干燥(e) 冷却.
查看习题详情和答案>>

(1)写出铝、氧化铝分别与盐酸反应的离子方程式:
2Al+6H+=2Al3++3H2↑
2Al+6H+=2Al3++3H2↑
,Al2O3+6H+=2Al3++3H2O
Al2O3+6H+=2Al3++3H2O
,(2)用36.5%的盐酸配制20%的盐酸,操作步骤是
计算、量取、稀释
计算、量取、稀释
(依次写出),配制过程中所需的定量仪器是量筒
量筒
.(3)聚合铝(PAC)的分子式为[Al2(OH)aClb]m,聚合铝中OH-与Al3+的比值对净水效果有很大影响,定义盐基度B=n(OH-)/3n(Al3+),当B=2/3时,b=
2
2
(填入合适数字).(4)聚合过程主要利用了Al3+的性质是
水解性
水解性
.(5)要测定1mol聚合铝中a的值.
①测定时所需的试剂是
bd
bd
(填代号).(a) NaOH(b)AgNO3(c) pH试纸(d) HNO3
②需要直接测定的物理量是
氯化银沉淀的质量
氯化银沉淀的质量
(用文字表示).若该物理量的数值用β表示,试写出聚合铝中a值的表达式6-
| β |
| 143.5 |
6-
.| β |
| 143.5 |
③测定过程中所需的基本操作是
cbadec
cbadec
(按操作先后顺序的代号列出,可重复选择).(a) 洗涤(b) 过滤(c) 称量 (d) 干燥(e) 冷却.
(2011?南京模拟)工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝.工艺流程如下图:
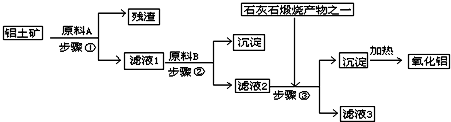
(1)原料A的名称是
(2)滤液1中要加入稍过量原料B,原料B的化学式是
(3)步骤③的化学方程式是:
(4)如果省去步骤①,即溶解铝土矿是从加入原料B开始,后续操作不变,则会对氧化铝的提取有什么影响
查看习题详情和答案>>

(1)原料A的名称是
盐酸
盐酸
,步骤①反应的离子方程式是Al2O3+6H+=2Al3++3H2O;Fe2O3+6H+=2Fe3++3H2O
Al2O3+6H+=2Al3++3H2O;Fe2O3+6H+=2Fe3++3H2O
.(2)滤液1中要加入稍过量原料B,原料B的化学式是
NaOH
NaOH
,步骤②反应的离子方程式是:H++OH-=H2O、Fe3++3OH-=Fe(OH)3、Al3++4OH-=AlO2-+2H2O
H++OH-=H2O、Fe3++3OH-=Fe(OH)3、Al3++4OH-=AlO2-+2H2O
.(3)步骤③的化学方程式是:
NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
.(4)如果省去步骤①,即溶解铝土矿是从加入原料B开始,后续操作不变,则会对氧化铝的提取有什么影响
若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,通入二氧化碳会生成硅酸沉淀,最后使加热制得的Al2O3混有SiO2杂质
若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,通入二氧化碳会生成硅酸沉淀,最后使加热制得的Al2O3混有SiO2杂质
.