题目内容
(2011?南京模拟)工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝.工艺流程如下图:
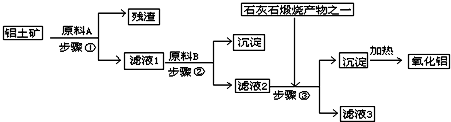
(1)原料A的名称是
(2)滤液1中要加入稍过量原料B,原料B的化学式是
(3)步骤③的化学方程式是:
(4)如果省去步骤①,即溶解铝土矿是从加入原料B开始,后续操作不变,则会对氧化铝的提取有什么影响

(1)原料A的名称是
盐酸
盐酸
,步骤①反应的离子方程式是Al2O3+6H+=2Al3++3H2O;Fe2O3+6H+=2Fe3++3H2O
Al2O3+6H+=2Al3++3H2O;Fe2O3+6H+=2Fe3++3H2O
.(2)滤液1中要加入稍过量原料B,原料B的化学式是
NaOH
NaOH
,步骤②反应的离子方程式是:H++OH-=H2O、Fe3++3OH-=Fe(OH)3、Al3++4OH-=AlO2-+2H2O
H++OH-=H2O、Fe3++3OH-=Fe(OH)3、Al3++4OH-=AlO2-+2H2O
.(3)步骤③的化学方程式是:
NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
.(4)如果省去步骤①,即溶解铝土矿是从加入原料B开始,后续操作不变,则会对氧化铝的提取有什么影响
若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,通入二氧化碳会生成硅酸沉淀,最后使加热制得的Al2O3混有SiO2杂质
若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,通入二氧化碳会生成硅酸沉淀,最后使加热制得的Al2O3混有SiO2杂质
.分析:SiO2和盐酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能反应,向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀.
由工艺流程可知步骤③通入的为二氧化碳,生成的沉淀为氢氧化铝,所以滤液②含有AlO2-.步骤②应加入氢氧化钠,除去铁离子,将铝离子转化为AlO2-,所以滤液①中含有Al3+,步骤①应为加入盐酸,除去SiO2.
由工艺流程可知步骤③通入的为二氧化碳,生成的沉淀为氢氧化铝,所以滤液②含有AlO2-.步骤②应加入氢氧化钠,除去铁离子,将铝离子转化为AlO2-,所以滤液①中含有Al3+,步骤①应为加入盐酸,除去SiO2.
解答:解:由工艺流程可知步骤③通入的为二氧化碳,生成的沉淀为氢氧化铝,所以滤液②含有AlO2-.步骤②应加入氢氧化钠,所以滤液①中含有Al3+,步骤①应为加入盐酸,除去SiO2.
(1)由上述分析可知,步骤①加入盐酸,除去SiO2,所以原料A为盐酸,
氧化铝与酸反应离子方程式为Al2O3+6H+=2Al3++3H2O,氧化铁与盐酸反应离子方程式为Fe2O3+6H+=2Fe3++3H2O.
故答案为:Al2O3+6H+=2Al3++3H2O;Fe2O3+6H+=2Fe3++3H2O.
(2)步骤①加入过量盐酸,滤液①中含有Al3+、Fe3+、H+等,应加入氢氧化钠,除去铁离子,将铝离子转化为AlO2-,反应为 H++OH-=H2O,Fe3++3OH-=Fe(OH)3↓,Al3++4OH-=AlO2-+2H2O.
故答案为:NaOH; H++OH-=H2O、Fe3++3OH-=Fe(OH)3、Al3++4OH-=AlO2-+2H2O.
(3)滤液②含有AlO2-,步骤③通入二氧化碳,与AlO2-反应生成的沉淀为氢氧化铝,
反应化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3.
故答案为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3.
(4)若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,通入二氧化碳会生成硅酸沉淀,最后使加热制得的Al2O3混有SiO2杂质.
故答案为:若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后使加热制得的Al2O3混有SiO2杂质.
(1)由上述分析可知,步骤①加入盐酸,除去SiO2,所以原料A为盐酸,
氧化铝与酸反应离子方程式为Al2O3+6H+=2Al3++3H2O,氧化铁与盐酸反应离子方程式为Fe2O3+6H+=2Fe3++3H2O.
故答案为:Al2O3+6H+=2Al3++3H2O;Fe2O3+6H+=2Fe3++3H2O.
(2)步骤①加入过量盐酸,滤液①中含有Al3+、Fe3+、H+等,应加入氢氧化钠,除去铁离子,将铝离子转化为AlO2-,反应为 H++OH-=H2O,Fe3++3OH-=Fe(OH)3↓,Al3++4OH-=AlO2-+2H2O.
故答案为:NaOH; H++OH-=H2O、Fe3++3OH-=Fe(OH)3、Al3++4OH-=AlO2-+2H2O.
(3)滤液②含有AlO2-,步骤③通入二氧化碳,与AlO2-反应生成的沉淀为氢氧化铝,
反应化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3.
故答案为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3.
(4)若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,通入二氧化碳会生成硅酸沉淀,最后使加热制得的Al2O3混有SiO2杂质.
故答案为:若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后使加热制得的Al2O3混有SiO2杂质.
点评:本题以框图题形式考查铝的化合物的性质,难度中等,清楚冶炼铝工艺流程原理,是对知识迁移的综合运用.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
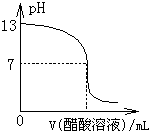 (2011?南京模拟)常温下,向10mL 0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1醋酸溶液,所得滴定曲线如图所示.下列说法正确的是( )
(2011?南京模拟)常温下,向10mL 0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1醋酸溶液,所得滴定曲线如图所示.下列说法正确的是( )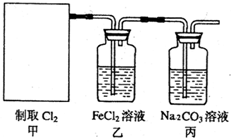 (2011?南京模拟)氯气是一种重要的化工原料.
(2011?南京模拟)氯气是一种重要的化工原料.