摘要:12.取一定量的PbI2固体用蒸馏水配成饱和溶液.量取25.00mLPbI2饱和溶液.分次慢慢加入交换柱.进行如下离子交换反应:Pb2+ =R2Pb(s)+2H+(aq),用洁净的锥形瓶接流出液,待溶液流出后,再用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并放在锥形瓶中.加入指示剂.用0.0025mol/LNaOH溶液滴定.当达到滴定终点时.用去氢氧化钠溶液20.00mL.结合上述实验数据.下列有关说法正确的是 A.常温下.0.0025mol/LNaOH溶液 pH=11.4 B.在温度不变时.向PbI2饱和溶液中加入少量硝酸铅浓溶液. PbI2的Ksp减小 C.温度不变.T时刻.向PbI2饱和溶液中加入少量KI 浓溶液.离子浓度变化如右图所示. D.本次实验测得的t℃ PbI2的Ksp=4×10-9 第Ⅱ卷 13.过氧化尿素[CO(NH2)2·H2O2]是一种无毒.无味的白色结晶粉末.具有尿素和过氧化氢双重性质.是一种新型的氧化剂和消毒剂.广泛应用于漂白.纺织.医药.农业.养殖业等领域.其合成如下: 试回答下列问题: (1)实际生产中需控制n(H2O2)∶n[CO(NH2)2]=1.2∶1.并控制合成温度在25-30℃.其主要原因是 ▲ . (2)从母液中分离出H2O2和尿素.采用的操作是 ▲ . 分液 过滤 常压蒸馏 萃取 (3)为测定产品中活性氧的含量(活性氧16%.相当于H2O234%).称取干燥样品12.000g.溶解.在250mL容量瓶中定容.准确量取25.00mL于锥形瓶中.加入1mL6mol/L的硫酸.然后用0.2000mol/LKMnO4标准溶液滴定.至滴入最后一滴时.溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液20.00mL(KmnO4溶液与尿素不反应). ①KMnO4溶液应盛放在 ▲ 式滴定管中. ②完成并配平方程式:MnO4-+H2O2+H+=Mn2++H2O+ ③根据滴定结果.可确定产品中活性氧的质量分数为: ▲ . ④若滴定前滴定管尖嘴处有气泡.滴定后消失.会使测得的活性氧含量 ▲ . (选填:“偏高 .“偏低 或“不变 ). ⑤根据本次实验测得的活性氧含量.可判断该实验产品所含的一种主要杂质为▲ . 14.由磷矿石.石英.氯化氢等为原料生产白炭黑(SiO2·nH2O).磷及甲醇.下列工艺过程原料综合利用率高.废弃物少. (1)上述反应中.属于置换反应的是 ▲ . (2)已知SiHCl3的沸点为33.0℃.提纯SiHCl3适宜的方法是 ▲ . (3)高温下进行的反应Ⅱ的化学方程式为: ▲ ,固体废弃物CaSiO3可用于 ▲ . (4)反应Ⅲ需在高温.隔绝氧气和无水条件下进行.其原因是 ▲ . (5)CH3OH可用作燃料电池的燃料.在强酸性介质中.负极的电极反应式为 ▲ . 15.钛是继铁.铝后的第三金属.常温下钛的化学活性很小.仅能与氟气.氢氟酸等几种物质起作用.但在较高温度下.钛可与多种单质和化合物发生反应.工业上冶炼钛主要以钛铁矿.金红石(含TiO2大于96%)等为原料生产. (1)由金红石为原料采用亨特法生产钛的流程如下: ①沸腾氯化炉中反应:TiO2(s) +2Cl2 (g)=TiCl4(l) + O2(g).在常温下能否自发进行(已知该反应△H=184kJ/mol.△S =57.74J/K) ▲ . ②已知:Ti(s) +2Cl2(g) = TiCl4(l) △H = -804.2kJ/mol, 2Na(s) +Cl2 △H = -882.0kJ/mol Na △H =2.6 kJ/mol 则TiCl4 +4NaCl(s) △H = ▲ kJ/mol ③海绵钛破碎后用0.5%-1.5%的盐酸洗涤.再用蒸馏水洗涤至中性.用盐酸洗涤的目的 ▲ . (2)科学家从电解冶炼铝的工艺得到启发.找出了冶炼钛的新工艺.试回答下列有关问题. ①TiO2直接电解法生产钛是一种较先进的方法.电解质为熔融的氯化钙.原理如右图所示,阴极获得钛可能发生的反应或电极反应为: ▲ . ②SOM技术是一种绿色环保先进技术.阳极用金属陶瓷.并用固体氧离子隔膜将两极产物隔开.阳极通入某种还原性气体.可防止CO.CO2污染物产生.通入的气体是 ▲ . (3)海棉钛通常需要经过真空电弧炉里熔炼提纯.也可通过碘提纯法.原理为: .下列说法正确的是 ▲ . (a) 该反应正反应为的△H>0 (b) 在不同温度区域.TiI4 的量保持不变 (c) 在提纯过程中.I2 的量不断减少 (d) 在提纯过程中.I2 的作用是将粗钛从低温区转移到高温区
网址:http://m.1010jiajiao.com/timu3_id_63610[举报]
取一定量的PbI2固体用蒸馏水配成饱和溶液,量取25.00mLPbI2饱和溶液,分次慢慢加入交换柱,进行如下离子交换反应:Pb2+(aq)+2R-H(s)=R2Pb(s)+2H+(aq),用洁净的锥形瓶接流出液,待溶液流出后,再用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并放在锥形瓶中,加入指示剂,用0.0025mol/LNaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL.结合上述实验数据(已知lg2=0.3),下列有关说法正确的是( )
查看习题详情和答案>>
取一定量的PbI2固体用蒸馏水配成饱和溶液,量取25.00mLPbI2饱和溶液,分次慢慢加入交换柱,进行如下离子交换反应:Pb2+(aq)+2R-H(s)=R2Pb(s)+2H+(aq),用洁净的锥形瓶接流出液,待溶液流出后,再用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并放在锥形瓶中,加入指示剂,用0.0025mol/LNaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL.结合上述实验数据(已知lg2=0.3),下列有关说法正确的是( )
查看习题详情和答案>>
| A.常温下,0.0025mol/LNaOH溶液 pH=11.4 |
| B.在温度不变时,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的Ksp减小 |
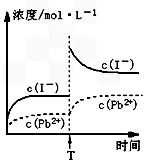
C.温度不变,T时刻,向PbI2饱和溶液中加入少量KI浓溶液,离子浓度变化如图所示 |
| D.本次实验测得的t℃PbI2的Ksp=4×10-9 |
常温下,取一定量金黄色的PbI2固体用蒸馏水配成饱和溶液,量取25.00mLPbI2饱和溶液,分次慢慢加入交换柱,进行离子交换反应:Pb2+ (aq)+2R-H(s)=R2Pb(s)+2H+(aq)。用洁净的锥形瓶接流出液,待溶液流出后,再用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并放在锥形瓶中,加入指示剂,用0.0025 mol·L-1 NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液的体积为20.00mL。(已知lg2=0.3),下列有关说法不正确的是
[ ]
A.常温下,0.0025mol·L-1 NaOH溶液的pH=11.4
B.PbI2饱和溶液接近无色
C.温度不变,T时刻,向PbI2饱和溶液中加入少量KI浓溶液,离子浓度变化如图所示
D.利用本次实验所测定的数据,可确定常温下PbI2的Ksp的数值为4×10-9
查看习题详情和答案>>
B.PbI2饱和溶液接近无色
C.温度不变,T时刻,向PbI2饱和溶液中加入少量KI浓溶液,离子浓度变化如图所示
D.利用本次实验所测定的数据,可确定常温下PbI2的Ksp的数值为4×10-9
取一定量的PbI2固体用蒸馏水配成饱和溶液,量取25.00mLPbI2饱和溶液,分次慢慢加入交换柱,进行如下离子交换反应:Pb2+(aq)+2R-H(s)=R2Pb(s)+2H+(aq),用洁净的锥形瓶接流出液,待溶液流出后,再用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并放在锥形瓶中,加入指示剂,用0.0025mol/LNaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL.结合上述实验数据(已知lg2=0.3),下列有关说法正确的是( )
A.常温下,0.0025mol/LNaOH溶液 pH=11.4
B.在温度不变时,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的Ksp减小
C.温度不变,T时刻,向PbI2饱和溶液中加入少量KI浓溶液,离子浓度变化如图所示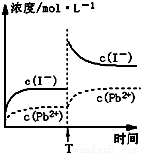
D.本次实验测得的t℃PbI2的Ksp=4×10-9
查看习题详情和答案>>
A.常温下,0.0025mol/LNaOH溶液 pH=11.4
B.在温度不变时,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的Ksp减小
C.温度不变,T时刻,向PbI2饱和溶液中加入少量KI浓溶液,离子浓度变化如图所示

D.本次实验测得的t℃PbI2的Ksp=4×10-9
查看习题详情和答案>>
铅及其化合物工业生产及日常生活具有非常广泛的用途。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ΔH=" a" kJ/mol
PbS(s)+2PbO(s)=3Pb(s)+SO2(g) ΔH=" b" kJ·mol-1
PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH=" c" kJ·mol-1
反应3PbS(s) + 6O2(g) = 3PbSO4(s) ΔH="kJ" ·mol-1(用含a,b ,c的代数式表示)。
(2)还原法炼铅,包含反应PbO(s)+CO(g) Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表
Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表
①该还原反应的△H0(选填:“>”“<”“=”)。
②当IgK=1且起始时只通入CO(PbO足量),达平衡时,混合气体中CO的体积分数为 。
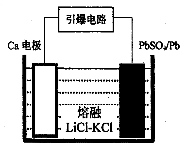
(3)引爆导弹、核武器的工作电源通常Ca/PbSO4热电池,其装置如图所示,该电池正极的电极反应式为 。
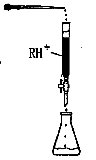
(4)PbI2:可用于人工降雨。取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00mLPbI2饱和溶液分次加入阳离子交换树脂RH+(发生:2RH++PbI2=R2Pb+2H++2I-),用250ml洁净的锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图)。加入酚酞指示剂,用0.0025mol·L-1NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL。可计算出t℃时PbI2 Ksp为 。
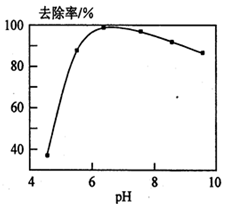
(5)铅易造成环境污染,水溶液中的铅存在形态主要有6种,它们与pH关系如图所示,含铅废水用活性炭进行处理,铅的去除率与pH关系如图所示。
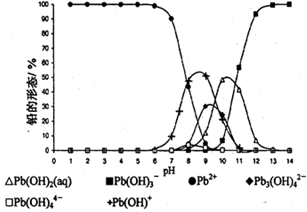
①常温下,pH=6→7时,铅形态间转化的离子方程式为 。
②用活性炭处理,铅的去除率较高时,铅主要应该处于 (填铅的一种形态的化学式)形态。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ΔH=" a" kJ/mol
PbS(s)+2PbO(s)=3Pb(s)+SO2(g) ΔH=" b" kJ·mol-1
PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH=" c" kJ·mol-1
反应3PbS(s) + 6O2(g) = 3PbSO4(s) ΔH="kJ" ·mol-1(用含a,b ,c的代数式表示)。
(2)还原法炼铅,包含反应PbO(s)+CO(g)
 Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表
Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表| 温度 | 300 | 727 | 1227 |
| lgK | 6.17 | 2.87 | 1.24 |
①该还原反应的△H0(选填:“>”“<”“=”)。
②当IgK=1且起始时只通入CO(PbO足量),达平衡时,混合气体中CO的体积分数为 。
(3)引爆导弹、核武器的工作电源通常Ca/PbSO4热电池,其装置如图所示,该电池正极的电极反应式为 。

(4)PbI2:可用于人工降雨。取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00mLPbI2饱和溶液分次加入阳离子交换树脂RH+(发生:2RH++PbI2=R2Pb+2H++2I-),用250ml洁净的锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图)。加入酚酞指示剂,用0.0025mol·L-1NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL。可计算出t℃时PbI2 Ksp为 。

(5)铅易造成环境污染,水溶液中的铅存在形态主要有6种,它们与pH关系如图所示,含铅废水用活性炭进行处理,铅的去除率与pH关系如图所示。


①常温下,pH=6→7时,铅形态间转化的离子方程式为 。
②用活性炭处理,铅的去除率较高时,铅主要应该处于 (填铅的一种形态的化学式)形态。