题目内容
| A.常温下,0.0025mol/LNaOH溶液 pH=11.4 |
| B.在温度不变时,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的Ksp减小 |
C.温度不变,T时刻,向PbI2饱和溶液中加入少量KI浓溶液,离子浓度变化如图所示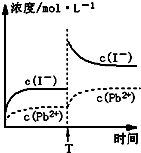 |
| D.本次实验测得的t℃PbI2的Ksp=4×10-9 |
| 10-14 |
| 0.0025 |
B、在温度不变时,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的Ksp不变,故B错误;
C、依据PbI2(s)?Pb2++2I-;温度不变,T时刻,向PbI2饱和溶液中加入少量KI浓溶液,平衡左移,平衡后溶液中碘离子浓度增大,铅离子浓度减小,故图象不正确,故C错误;
D、,用0.0025mol/LNaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL,测得氢离子物质的量为5×10-5mol,依据Pb2+(aq)+2R-H(s)=R2Pb(s)+2H+(aq),计算得到Pb2+物质的量=2.5×10-5mol;n(I-)=5×10-5mol;Ksp=c(Pb2+)×c2(I-)
| 2.5×10-5mol |
| 0.025L |
| 5×10-5mol |
| 0.025L |
故选AD.

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案铅及其化合物工业生产及日常生活具有非常广泛的用途。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ΔH= a kJ/mol
PbS(s)+2PbO(s)=3Pb(s)+SO2(g) ΔH= b kJ·mol-1
PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH= c kJ·mol-1
反应3PbS(s) + 6O2(g) = 3PbSO4(s) ΔH=kJ ·mol-1(用含a,b ,c的代数式表示)。
(2)还原法炼铅,包含反应PbO(s)+CO(g)  Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表
Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表
|
温度 |
300 |
727 |
1227 |
|
lgK |
6.17 |
2.87 |
1.24 |
①该还原反应的△H0(选填:“>”“<”“=”)。
②当IgK=1且起始时只通入CO(PbO足量),达平衡时,混合气体中CO的体积分数为 。
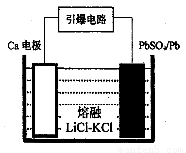
(3)引爆导弹、核武器的工作电源通常Ca/PbSO4热电池,其装置如图所示,该电池正极的电极反应式为 。
(4)PbI2:可用于人工降雨。取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00mLPbI2饱和溶液分次加入阳离子交换树脂RH+(发生:2RH++PbI2=R2Pb+2H++2I-),用250ml洁净的锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图)。加入酚酞指示剂,用0.0025mol·L-1NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL。可计算出t℃时PbI2 Ksp为 。
(5)铅易造成环境污染,水溶液中的铅存在形态主要有6种,它们与pH关系如图所示,含铅废水用活性炭进行处理,铅的去除率与pH关系如图所示。
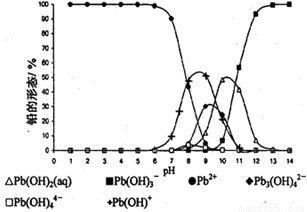

①常温下,pH=6→7时,铅形态间转化的离子方程式为 。
②用活性炭处理,铅的去除率较高时,铅主要应该处于 (填铅的一种形态的化学式)形态。

