网址:http://m.1010jiajiao.com/timu3_id_63131[举报]
 水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)═CO (g)+H2 (g)△H=+131.3kJ?mol-1
(1)该反应的平衡常数K随温度的升高而
(2)上述反应达到平衡后,将体系中的C(s)全部移走,平衡
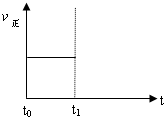
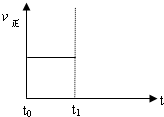
(3)上述反应在t0时刻达到平衡(如图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
①缩小容器体积(用实线表示)
②降低温度(用虚线表示)
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器编号 | c(H2O)/mol?L-1 | c(CO)/mol?L-1 | c(H2)/mol?L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | 0.6 0.6 |
ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正 > > ν逆 |
水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g) CO (g) +H2 (g) △H= +131.3 kJ?mol-1(······①
CO (g) +H2 (g) △H= +131.3 kJ?mol-1(······①
(1)实际工业生产中,向炭层间隔交替通入水蒸气和空气,其中通入空气的原因是由于该反应是吸热,导致炭层温度降低,须及时通入富氧空气促进炭层的燃烧放热:
C (s) + O2(g)= CO2 (g);△H = -393.5kJ·mo1-1 ······②
为保持生产的连续性,若不考虑其它热量的产生和损耗,则每间隔应通入的水蒸气和空气的体积比(同温同压)约为多少?(设空气中氧气的体积占1/5)
(2)一定温度下,三个容器中均进行着上述反应①,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。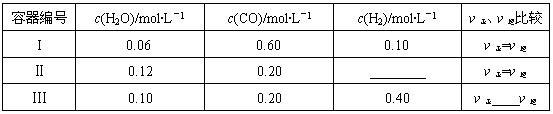
(3)生物乙醇可由淀粉或纤维素等生物质原料发酵获得。利用乙醇可进而获得合成气(CO、H2)。用乙醇生产合成气有如下两条路线:
a、水蒸气催化重整:CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g)
b、部分催化氧化:CH3CH2OH(g)+1/2O2(g)→3H2(g)+2CO(g)
某生物质能研究所准备利用乙醇得到的合成气合成一种生物汽油。乙醇各分一半按a、b两式反应。合成气合成生物汽油的反应为:2mCO+(2m+n)H2→2CmHn+2mH2O。假定合成的生物汽油中含有X、Y两种成分,且X、Y都是有8个碳原子的烃,X是苯的同系物,Y是烷烃。
①X的分子式为 ,Y的分子式为 。
②50吨质量分数为92%的乙醇经上述转化(假定各步转化率均为100%),则最终可获得X的质量为多少吨?
C (s) + H2O(g)
 CO (g) +H2 (g) △H
CO (g) +H2 (g) △H (1)写出该反应的平衡常数表达式:K=_______,已知:K300℃<K350℃,则该反应是_______热反应。
(2)上述反应达到平衡后,增加H2O(g)的量,则C(s)的物质的量_______(增大、减小、不变)
(3)下列说法一定能判断如上反应达平衡的是__________
A.消耗1mol H2O(g)同时生成1mol H2
B.容器内混合气体的总质量不变
C.恒温恒容时容器内气体的压强不变
D.H2O(g) 、CO (g) 、H2 (g)三种气体的浓度比为1︰1︰1.
E.恒温恒容时容器内气体的密度不变
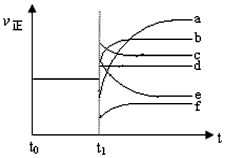
(4)上述反应在t0时刻达到平衡,在t1时刻改变某一条件后正反应速率(ν正)随时间的变化如下图所示,填出对应的编号。 ① 缩小容器体积_________; ② 降低温度 ____________。

C (s)+H2O(g)═CO (g)+H2 (g)△H=+131.3kJ?mol-1
(1)该反应的平衡常数K随温度的升高而______(增大/减小/不变).
(2)上述反应达到平衡后,将体系中的C(s)全部移走,平衡______(向左移/向右移/不移动).
(3)上述反应在t0时刻达到平衡(如图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
①缩小容器体积(用实线表示)
②降低温度(用虚线表示)
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器编号 | c(H2O)/mol?L-1 | c(CO)/mol?L-1 | c(H2)/mol?L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | ______ | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正______ν逆 |
水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g) ![]() CO (g) +H2 (g) △H= +131.3 kJ??mol-1(······①
CO (g) +H2 (g) △H= +131.3 kJ??mol-1(······①
(1)实际工业生产中,向炭层间隔交替通入水蒸气和空气,其中通入空气的原因是由于该反应是吸热,导致炭层温度降低,须及时通入富氧空气促进炭层的燃烧放热:
C (s) + O2(g)= CO2 (g);△H = -393.5kJ·mo1-1 ······②
为保持生产的连续性,若不考虑其它热量的产生和损耗,则每间隔应通入的水蒸气和空气的体积比(同温同压)约为多少?(设空气中氧气的体积占1/5)
(2)一定温度下,三个容器中均进行着上述反应①,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。

(3)生物乙醇可由淀粉或纤维素等生物质原料发酵获得。利用乙醇可进而获得合成气(CO、H2)。用乙醇生产合成气有如下两条路线:
a、水蒸气催化重整:CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g)
b、部分催化氧化:CH3CH2OH(g)+1/2O2(g)→3H2(g)+2CO(g)
某生物质能研究所准备利用乙醇得到的合成气合成一种生物汽油。乙醇各分一半按a、b两式反应。合成气合成生物汽油的反应为:2mCO+(2m+n)H2→2CmHn+2mH2O。假定合成的生物汽油中含有X、Y两种成分,且X、Y都是有8个碳原子的烃,X是苯的同系物,Y是烷烃。
①X的分子式为 ,Y的分子式为 。
②50吨质量分数为92%的乙醇经上述转化(假定各步转化率均为100%),则最终可获得X的质量为多少吨?
查看习题详情和答案>>