题目内容
水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g)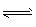 CO (g) +H2 (g) △H
CO (g) +H2 (g) △H
(1)写出该反应的平衡常数表达式:K=_______,已知:K300℃<K350℃,则该反应是_______热反应。
(2)上述反应达到平衡后,增加H2O(g)的量,则C(s)的物质的量_______(增大、减小、不变)
(3)下列说法一定能判断如上反应达平衡的是__________
A.消耗1mol H2O(g)同时生成1mol H2
B.容器内混合气体的总质量不变
C.恒温恒容时容器内气体的压强不变
D.H2O(g) 、CO (g) 、H2 (g)三种气体的浓度比为1︰1︰1.
E.恒温恒容时容器内气体的密度不变
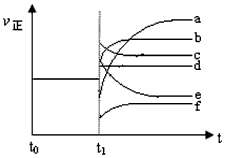
(4)上述反应在t0时刻达到平衡,在t1时刻改变某一条件后正反应速率(ν正)随时间的变化如下图所示,填出对应的编号。 ① 缩小容器体积_________; ② 降低温度 ____________。
C (s) + H2O(g)
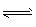 CO (g) +H2 (g) △H
CO (g) +H2 (g) △H (1)写出该反应的平衡常数表达式:K=_______,已知:K300℃<K350℃,则该反应是_______热反应。
(2)上述反应达到平衡后,增加H2O(g)的量,则C(s)的物质的量_______(增大、减小、不变)
(3)下列说法一定能判断如上反应达平衡的是__________
A.消耗1mol H2O(g)同时生成1mol H2
B.容器内混合气体的总质量不变
C.恒温恒容时容器内气体的压强不变
D.H2O(g) 、CO (g) 、H2 (g)三种气体的浓度比为1︰1︰1.
E.恒温恒容时容器内气体的密度不变
(4)上述反应在t0时刻达到平衡,在t1时刻改变某一条件后正反应速率(ν正)随时间的变化如下图所示,填出对应的编号。 ① 缩小容器体积_________; ② 降低温度 ____________。
(5)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中①②相应的空格。

(1)表达式K= C(CO)·C(H2) / C(H2O); 吸
(2)减小
(3)BCE
(4)①b;②f
(5)①0.60; ②>
(2)减小
(3)BCE
(4)①b;②f
(5)①0.60; ②>

练习册系列答案
相关题目
 发生如下反应:
发生如下反应: ;
;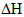 的含义是(填序号):___________。
的含义是(填序号):___________。 与反应生成
与反应生成 时放出的热量
时放出的热量  与反应生成
与反应生成 时吸收的热量
时吸收的热量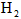 的转化率__________,化学反应速率_____
的转化率__________,化学反应速率_____ 、
、 。平衡后,两容器内放出的热量分别记作
。平衡后,两容器内放出的热量分别记作 的关系是__________。
的关系是__________。 B.
B.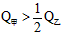 C.
C.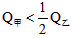 D.无法确定
D.无法确定  2HI(g);△H <0。有相同容积的定容密闭容器甲和乙,甲 中加入H2和I2各0.2 mol,乙中加入HI 0.4mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
2HI(g);△H <0。有相同容积的定容密闭容器甲和乙,甲 中加入H2和I2各0.2 mol,乙中加入HI 0.4mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是 3C(g)+2D(g)起始时四个容器所盛A、B的量分别为:甲:2 mol A,1 mol B;乙:1 mol A,1 mol B;丙:2 mol A,2 mol B;丁:1 mol A,2 mol B。在相同温度下建立平衡时,A、B的转化率大小关系正确
3C(g)+2D(g)起始时四个容器所盛A、B的量分别为:甲:2 mol A,1 mol B;乙:1 mol A,1 mol B;丙:2 mol A,2 mol B;丁:1 mol A,2 mol B。在相同温度下建立平衡时,A、B的转化率大小关系正确  3C(g)十D(s),达到平衡时C的浓度为1.2 mol/L。若维持容器体积和温度不变,按下列方法改变起始物质,达到平衡时C的浓度仍为1.2 mol/L的是
3C(g)十D(s),达到平衡时C的浓度为1.2 mol/L。若维持容器体积和温度不变,按下列方法改变起始物质,达到平衡时C的浓度仍为1.2 mol/L的是