网址:http://m.1010jiajiao.com/timu3_id_62361[举报]
A. H2+S![]() H2S, H2S
H2S, H2S![]() S+H2
S+H2
B. CuSO4•5H2O![]() CuSO4+5H2O, CuSO4+5H2O==CuSO4•5H2O
CuSO4+5H2O, CuSO4+5H2O==CuSO4•5H2O
C. 2SO2+O2![]() 2SO3, 2SO3
2SO3, 2SO3![]() 2SO2+O2
2SO2+O2
D. 2H2O![]() 2H2+O2, 2H2+O2
2H2+O2, 2H2+O2![]() 2H2O
2H2O
查看习题详情和答案>>
下列反应中,不属于可逆反应的是 ( )
A. H2+S![]() H2S, H2S
H2S, H2S![]() S+H2
S+H2
B. CuSO4•5H2O![]() CuSO4+5H2O, CuSO4+5H2O==CuSO4•5H2O
CuSO4+5H2O, CuSO4+5H2O==CuSO4•5H2O
C. 2SO2+O2![]() 2SO3, 2SO3
2SO3, 2SO3![]() 2SO2+O2
2SO2+O2
D. 2H2O![]() 2H2+O2, 2H2+O2
2H2+O2, 2H2+O2![]() 2H2O
2H2O
查看习题详情和答案>>
| A | ||||||||||||||||||
| M | B | D | ||||||||||||||||
| G | H | Q | R | |||||||||||||||
| E | ||||||||||||||||||


(2)E、Q、R三种元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)
(3)M、D两元素形成的化合物中含有的化学键类型是
(4)用表中所给元素组成反应物,用化学方程式说明元素Q和R非金属性的强弱:
过氧化氢是一种无色透明的无毒液体,是重要无机化工产品。试探究下列问题
(1)过氧化氢最适合贴上的一个标签是 。
|

(2)过氧化氢的制备方法很多,下列方法中原子利用率最高的是: 。
A. BaO 2 + H2SO 4 === BaSO4 ↓ + H2O2
B. 2NH4HSO4![]() (NH4)2S2O8 + H2↑,
(NH4)2S2O8 + H2↑,
然后水解 (NH4)2S2O8 + 2H2O =2NH4HSO4 + H2O2。
C.CH3CHOHCH3+O2→CH3COCH3+H2O2
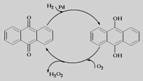
D.乙基蒽醌法:
(3)碱性氢氧燃料电池工作时可产生过氧化氢(见下左图),正极含碳(Carbon)的质量大小对产生过氧化氢的浓度(concentration)有影响(其影响曲线如下右图)。
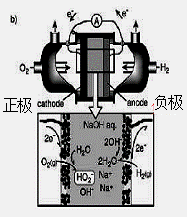
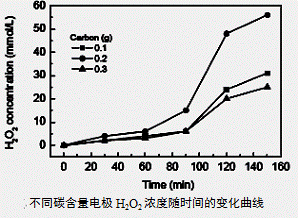
下列说法正确的有 。
A.开始时速率均较慢,说明电极有一个活化的过程
B.一段时间后,速率又再次平缓,说明生成与分解逐渐趋向平衡
C.正极室流出液经酸化后可分离出过氧化氢
D.正极含碳的质量以0.2g适宜
(4)过氧化氢作为一种绿色氧化剂有广泛应用,请写出下列反应的化学方程式:
①在过氧化氢作用下,铜与稀硫酸制硫酸铜: 。
②用Ti-Si分子筛作催化剂,甲苯被过氧化氢氧化为间-甲苯酚: 。
查看习题详情和答案>>|
a、b、c三种金属分别放入稀H2SO中,只有c产生H2,a、b同时放入a的硝酸盐溶液中,a的质量增加,则离子氧化能力的顺序是 | |
| [ ] | |
A. |
a2+>b2+>c2+>H+ |
B. |
b2+>a2+>c2+>H+ |
C. |
a2+>b2+>H+>C2+ |
D. |
c2+>H+>b2+>a2+ |