摘要:9.A.B.C.D.E.F均为短周期元素.它们的核电荷数依次增大.A.D均能与B按原子个数比1:1或2:1形成化合物.且按原子个数比1:1形成的化合物均具有漂白性,C与F处于元素周期表同一主族.其原子序数之和比D与E的原子序数之和少1. (1)B元素的原子结构示意图为 (2) 试推断C.D .E.F各是什么元素: C D E F (3)比较C.F的氢化物的沸点高低 .试分析其原因 (4)X由B.D.E三种元素组成.能与E的最高价氧化物的水化物的稀溶液反应.写出可能的离子反应方程式: (5)E的+4价气态氧化物Z与气态B单质反应生成气态产物时.每反应3.2 g Z,放出4.9 kJ热量.写出其热化学方程式:
网址:http://m.1010jiajiao.com/timu3_id_62351[举报]
A、B、C、D、E、F均为短周期元素,其原子序数依次增大.已知:A的最外层电子数等于其电子层数;B的最外层电子数是次外层电子数的两倍;D是地壳中含量最高的元素;D和F、A和E分别同主族;E是所有短周期主族元素中原子半径最大的元素.根据以上信息回答下列问题:
(1)B与D形成化合物BD2的结构式为
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为
(4)C2A4─空气燃料电池是一种碱性燃料电池.电解质溶液是20%~30%的KOH溶液.则燃料电池放电时:正极的电极反应式是
(5)已知:2CD2(g)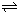 C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
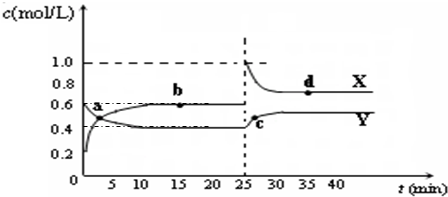
①a、b、c、d四个点中,化学反应处于平衡状态的是
②25min时,增加了
③a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是
查看习题详情和答案>>
(1)B与D形成化合物BD2的结构式为
O═C═O
O═C═O
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
.
| ||
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为
H++HSO3-═SO2↑+H2O
H++HSO3-═SO2↑+H2O
;由B、D、E组成的盐溶于水后溶液显碱性,其原因是(用离子方程式表示)CO32-+H2O HCO3-+OH-
HCO3-+OH-
 HCO3-+OH-
HCO3-+OH-CO32-+H2O HCO3-+OH-
HCO3-+OH-
. HCO3-+OH-
HCO3-+OH-(4)C2A4─空气燃料电池是一种碱性燃料电池.电解质溶液是20%~30%的KOH溶液.则燃料电池放电时:正极的电极反应式是
O2+2H2O+4e-═4OH-
O2+2H2O+4e-═4OH-
.(5)已知:2CD2(g)
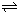 C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
①a、b、c、d四个点中,化学反应处于平衡状态的是
bd
bd
点.②25min时,增加了
NO2
NO2
(填物质的化学式)0.8
0.8
mol.③a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是
cdba
cdba
(填字母).A、B、C、D、E、F均为短周期元素,原子序数依次增大.A元素原子核内无中子.B元素原子核外最外层电子数是次外层电子数的2倍.C元素是地壳里含量最多的元素.D是短周期元素中金属性最强的元素.E与D元素的质子数之和为27,最外层电子数之差为5.F元素的最高价氧化物的水化物为最强酸.
(1)推断B元素在元素周期表中的位置:第 周期 族.
(2)画出F元素的原子结构示意图:
(3)A、E元素形成化合物(该化合物具有18电子),其电子式为:
(4)写出A与C元素形成10电子的一种微粒的化学式:
(5)C、D元素可形成淡黄色的粉末,B、C元素可形成由极性键构成的非极性分子,则两化合物之间发生反应的化学方程式为 .
查看习题详情和答案>>
(1)推断B元素在元素周期表中的位置:第
(2)画出F元素的原子结构示意图:
(3)A、E元素形成化合物(该化合物具有18电子),其电子式为:
(4)写出A与C元素形成10电子的一种微粒的化学式:
(5)C、D元素可形成淡黄色的粉末,B、C元素可形成由极性键构成的非极性分子,则两化合物之间发生反应的化学方程式为
A、B、C、D、E、F均为短周期元素,原子序数依次递增.A元素原子核内无中子.B元素原子最外层电子数是次外层电子数的2倍.C元素是地壳是含量最多的元素.D是短周期元素中金属性最强的元素.E与F的位置相邻,F的最高价氧化物的水化物为最强的酸.
(1)推断B在元素周期表中的位置: .
(2)写出A与C形成的10电子的阳离子化学式: .(用对应的化学符号填空,下同)
(3)E、F两种元素中非金属性较强的是 ;用电子式表示D2C形成过程
(4)D、E形成的正盐的水溶液中,阴离子的浓度大小顺序为: (从大到小排列).
(5)常温下,1molA元素的单质与C元素的单质化合,放出286kJ的热量,写出反应的热化学方程式: .
(6)甲是A和C按原子个数比1:1组成的化合物.已知甲的溶液能使酸性高锰酸钾溶液褪色.将含有0.5mol甲的溶液滴加到100mL 2mol/L酸性高锰酸钾溶液中,溶液紫色恰好褪去,该反应的离子方程式为 .
查看习题详情和答案>>
(1)推断B在元素周期表中的位置:
(2)写出A与C形成的10电子的阳离子化学式:
(3)E、F两种元素中非金属性较强的是
(4)D、E形成的正盐的水溶液中,阴离子的浓度大小顺序为:
(5)常温下,1molA元素的单质与C元素的单质化合,放出286kJ的热量,写出反应的热化学方程式:
(6)甲是A和C按原子个数比1:1组成的化合物.已知甲的溶液能使酸性高锰酸钾溶液褪色.将含有0.5mol甲的溶液滴加到100mL 2mol/L酸性高锰酸钾溶液中,溶液紫色恰好褪去,该反应的离子方程式为
A、B、C、D、E、F均为短周期元素;A、C具有相同的电子层数;E元素在B的下一周期;A与D同主族;原子半径大小为F>E>A>B>C.AC2常温下呈气态,通入紫色的石蕊溶液中会变红色,单质E可以在AC2中燃烧,发生置换反应.
回答:
(1)AC2的分子构型为 ,E在AC2中燃烧的化学方程式为 .
(2)A、D的最高价氧化物熔点更高是 (填物质化学式),其理由是 .
(3)B、C、E、F均能形成简单离子,其半径由大到小的顺序为 .(用离子符号表示)
(4)F3B是一种离子化合物,能与水反应生成两种碱性物质.将F3B加入到足量的盐酸中,写出发生反应的离子方程式 .
(5)A、E两元素形成阴、阳离子质量比为1:1的离子化合物能与水反应生成一种气体,此气体的结构式为 .
查看习题详情和答案>>
回答:
(1)AC2的分子构型为
(2)A、D的最高价氧化物熔点更高是
(3)B、C、E、F均能形成简单离子,其半径由大到小的顺序为
(4)F3B是一种离子化合物,能与水反应生成两种碱性物质.将F3B加入到足量的盐酸中,写出发生反应的离子方程式
(5)A、E两元素形成阴、阳离子质量比为1:1的离子化合物能与水反应生成一种气体,此气体的结构式为
A、B、C、D、E、F均为短周期元素,其原子序数依次增大.已知:A的最外层电子数等于其电子层数;B的最外层电子数是次外层电子数的两倍;D是地壳中含量最高的元素;D和F、A和E分别同主族;E是所有短周期主族元素中原子半径最大的元素.根据以上信息回答下列问题:
(1)B与D形成化合物BD2的结构式为 ,B元素形成的同素异形体的晶体类型可能是 .
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式 . FB2气体通入BaCl2和甲的混合溶液,生成白色沉淀和无色气体CD,有关反应的离子方程式为 .
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为 ;由B、D、E组成的盐溶于水后溶液显碱性,其原因是(用离子方程式表示) .
(4)C2A4─空气燃料电池是一种碱性燃料电池.电解质溶液是20%~30%的KOH溶液.则燃料电池放电时:正极的电极反应式是 ;负极的电极反应式为 .
查看习题详情和答案>>
(1)B与D形成化合物BD2的结构式为
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为
(4)C2A4─空气燃料电池是一种碱性燃料电池.电解质溶液是20%~30%的KOH溶液.则燃料电池放电时:正极的电极反应式是