摘要:1.已知A.B.C.D.E都是周期表中前四周期的元素.它们的核电荷数A<B<C<D<E.其中A.B.C是同一周期的非金属元素.化合物DC的晶体为离子晶体.D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子.B.C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的原子序数为24.ECl3能与B.C的氢化物形成六配位的配合物.且两种配体的物质的量之比为2∶1.三个氯离子位于外界.请根据以上情况.回答下列问题:(答题时.A.B.C.D.E用所对应的元素符号表示) (1)A.B.C的第一电离能由小到大的顺序为 . (2)B的氢化物的分子空间构型是 .其中心原子采取 杂化. (3)写出化合物AC2的电子式 ,一种由B.C组成的化合物与AC2互为等电子体.其化学式为 . (4)E的核外电子排布式是 .ECl3形成的配合物的化学式为 . (5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时.B被还原到最低价.该反应的化学方程式是 .
网址:http://m.1010jiajiao.com/timu3_id_62109[举报]
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为
(2)B的氢化物的分子空间构型是
(3)写出化合物AC2的电子式
 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为
;一种由B、C组成的化合物与AC2互为等电子体,其化学式为
(4)E的核外电子排布式是
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是
查看习题详情和答案>>
(1)A、B、C的第一电离能由小到大的顺序为
C<O<N
C<O<N
.(2)B的氢化物的分子空间构型是
三角锥型
三角锥型
.其中心原子采取sp3
sp3
杂化.(3)写出化合物AC2的电子式


N2O
N2O
.(4)E的核外电子排布式是
1s22s22p63s23p63d54s1
1s22s22p63s23p63d54s1
,ECl3形成的配合物的化学式为[Cr(NH3)4(H2O)2]Cl3
[Cr(NH3)4(H2O)2]Cl3
.(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是
4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O
4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O
.已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为
(2)B的氢化物的分子空间构型是
(3)写出化合物AC2的电子式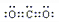
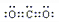 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为
;一种由B、C组成的化合物与AC2互为等电子体,其化学式为
(4)ECl3形成的配合物的化学式为
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是
查看习题详情和答案>>
(1)A、B、C的第一电离能由小到大的顺序为
C<O<N
C<O<N
.(2)B的氢化物的分子空间构型是
三角锥形
三角锥形
.其中心原子采取sp3
sp3
杂化.(3)写出化合物AC2的电子式
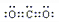
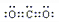
N2O
N2O
.(4)ECl3形成的配合物的化学式为
[Cr(NH3)4(H2O)2]Cl3
[Cr(NH3)4(H2O)2]Cl3
.(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是
4Mg+10HNO3=4Mg(NO3)2+NH4NO3 +3H2O
4Mg+10HNO3=4Mg(NO3)2+NH4NO3 +3H2O
.已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为
(2)B的氢化物的分子空间构型是
(3)写出化合物AC2的电子式
 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为
;一种由B、C组成的化合物与AC2互为等电子体,其化学式为
(4)E的核外电子排布式是
查看习题详情和答案>>
(1)A、B、C的第一电离能由小到大的顺序为
C<O<N
C<O<N
.(2)B的氢化物的分子空间构型是
三角锥型
三角锥型
.其中心原子采取sp3
sp3
杂化.(3)写出化合物AC2的电子式


N2O
N2O
.(4)E的核外电子排布式是
1s22s22p63s23p63d54s1
1s22s22p63s23p63d54s1
,ECl3形成的配合物的化学式为[Cr(NH3)4(H2O)2]Cl3
[Cr(NH3)4(H2O)2]Cl3
.已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E的原子序数为26.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)下列叙述正确的是
a.M分子空间构型为平面三角形,而BD2为直线形,BA4为正四面体形
b.M和BD2分子中的中心原子均采取sp2杂化,而CA3分子中采取sp3杂化
c.N 是非极性分子,且分子中σ键 和π键的个数比为3:1
d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
(2)B、C、D三种元素的电负性由小到大的顺序为
(3)化合物CA3的沸点比化合物BA4的高,其主要原因是
(4)B、D、E三元素能形成化合物E(BD)5,常温下呈液态,熔点为-20.5℃,沸点为103℃.据此可判断E(BD)5晶体为
(5)化合物BD与元素B、C形成的阴离子互为等电子体,阴离子的化学式是
查看习题详情和答案>>
(1)下列叙述正确的是
ad
ad
.(填字母)a.M分子空间构型为平面三角形,而BD2为直线形,BA4为正四面体形
b.M和BD2分子中的中心原子均采取sp2杂化,而CA3分子中采取sp3杂化
c.N 是非极性分子,且分子中σ键 和π键的个数比为3:1
d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
(2)B、C、D三种元素的电负性由小到大的顺序为
C<N<O
C<N<O
;C的第一电离能大于D的第一电离能原因是N原子2p轨道处于半充满状态,能量低
N原子2p轨道处于半充满状态,能量低
.(3)化合物CA3的沸点比化合物BA4的高,其主要原因是
NH3分子之间存在氢键
NH3分子之间存在氢键
.(4)B、D、E三元素能形成化合物E(BD)5,常温下呈液态,熔点为-20.5℃,沸点为103℃.据此可判断E(BD)5晶体为
分子晶体
分子晶体
.基态E2+离子的电子排布式为1s22s22p63s23p63d6
1s22s22p63s23p63d6
.(5)化合物BD与元素B、C形成的阴离子互为等电子体,阴离子的化学式是
CN-
CN-
.已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层 只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的核外电子排布式是 ,A、B、C、D的第一电离能由小到大的顺序为 。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是 ;
(3)A的最高价含氧酸根离子中,其中心原子采取 杂化,D的低价氧化物分子的空间构型是 。
(4)A、E形成某种化合物的晶胞结构如图所示,则其化学式为 ;(每个球均表示1个 原子)
查看习题详情和答案>>