摘要:4mol (D)6.22mol/L [简析]解题思路同上.选B.D.
网址:http://m.1010jiajiao.com/timu3_id_61013[举报]
下表为长式周期表的一部分,其中的编号代表对应的元素.
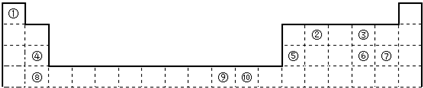
请回答下列问题:
(1)表中属于S区的元素是
(2)写由上述元素组成的分子中电子总数为10,其VSEPR模型与分子立体构型不一致的分子的分子式:
(3)元素①与②组成的化合物中,有一种含6原子分子是重要的化工原料,常把该物质作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是
A.属于含有极性键的极性分子
B.含有4个sp-s的σ键和1个p-p的π键
C.该分子中②原子采用sp2杂化
(4)某元素的价电子排布式为nsnnpn+1,该元素与元素①形成的18电子的分子的电子式为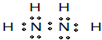
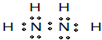 ;
;
(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据.
请回答:表中的非金属元素是
查看习题详情和答案>>

请回答下列问题:
(1)表中属于S区的元素是
①④⑧
①④⑧
(填编号).(2)写由上述元素组成的分子中电子总数为10,其VSEPR模型与分子立体构型不一致的分子的分子式:
NH3、H2O
NH3、H2O
.(3)元素①与②组成的化合物中,有一种含6原子分子是重要的化工原料,常把该物质作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是
C
C
.A.属于含有极性键的极性分子
B.含有4个sp-s的σ键和1个p-p的π键
C.该分子中②原子采用sp2杂化
(4)某元素的价电子排布式为nsnnpn+1,该元素与元素①形成的18电子的分子的电子式为
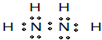
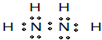
(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据.
| 电子能I(Ev) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
ABC
ABC
(填字母);若E、F为原子序数依次增大的同周期相邻元素,表中显示E比F的第一电离能略大,其原因是Mg的3s轨道上的电子全充满,能量比Al低,自身更稳定,所以第一电离能比Al大
Mg的3s轨道上的电子全充满,能量比Al低,自身更稳定,所以第一电离能比Al大
.含有2~5个碳原子的直链烷烃沸点和燃烧热的数据见表:
|
查看习题详情和答案>>
含有2~5个碳原子的直链烷烃沸点和燃烧热的数据见下表:
*燃烧热:1mol物质完全燃烧,生成二氧化碳、液态水时所放出的热量.
根据表中数据,下列判断错误的是( )
| 烷烃名称 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 沸点(℃) | -88.6 | -42.1 | -0.5 | 36.1 |
| *燃烧热(kJ?mol-1) | 1560.7 | 2219.2 | 2877.6 | 3535.6 |
根据表中数据,下列判断错误的是( )
| A、正庚烷在常温常压下肯定不是气体 |
| B、烷烃的燃烧热和其所含碳原子数成线性关系 |
| C、随着烷烃中碳原子数增加,烷烃的沸点逐渐升高 |
| D、随着烷烃中氢元素的质量分数增大,烷烃的燃烧热逐渐增大 |
下表为长式周期表的一部分,其中的编号代表对应的元素.

请回答下列问题:
(1)图1中属于d区的元素是
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图2所示(图中②、④、⑨分别位于
晶胞的体心、顶点、面心),则该化合物的化学式为
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是
A.分子中含有分子间的氢键 B.属于含有极性键的非极性分子
C.只含有4个sp-s的σ键和1个p-p的π键D.该氢化物分子中②原子采用sp2杂化
(4)某元素的价电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为
 ;该元素还可与元素①形成10电子的气体分子Y(分子量17),将过量的Y气体通入盛有硫酸铜水溶液的试管里,现象为
;该元素还可与元素①形成10电子的气体分子Y(分子量17),将过量的Y气体通入盛有硫酸铜水溶液的试管里,现象为
(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据.
请回答:表中的金属元素是
查看习题详情和答案>>

请回答下列问题:
(1)图1中属于d区的元素是
⑨
⑨
(填编号).(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图2所示(图中②、④、⑨分别位于
晶胞的体心、顶点、面心),则该化合物的化学式为
MgCNi3或CMgNi3
MgCNi3或CMgNi3
(用对应的元素符号表示).(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是
BD
BD
.A.分子中含有分子间的氢键 B.属于含有极性键的非极性分子
C.只含有4个sp-s的σ键和1个p-p的π键D.该氢化物分子中②原子采用sp2杂化
(4)某元素的价电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为
1
1
;该元素与元素①形成的18电子的X分子(分子量32)的电子式为

先产生蓝色沉淀,后沉淀消失,变成深蓝色的溶液
先产生蓝色沉淀,后沉淀消失,变成深蓝色的溶液
.(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据.
| 电离能I(eV) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
DEF
DEF
(填字母);若A、B、C为原子序数依次增大的同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是B的np轨道上的电子半满,能量比A和C低,自身更稳定,所以第一电离能比A和C大
B的np轨道上的电子半满,能量比A和C低,自身更稳定,所以第一电离能比A和C大
.含有2~5个碳原子的直链烷烃沸点和燃烧热的数据见下表:
|
查看习题详情和答案>>