摘要:氧化还原反应的一般规律 (1)得失电子守恒规律 (2)价态与表现性质规律: (3)性质强弱规律:氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物. 如:2FeCl3+Cu====2FeCl2+CuCl2.氧化性:Fe3+>Cu2+.还原性:Cu>Fe2+. (4)反应先后规律:如:把Cl2通入FeBr2溶液中.由于还原性Fe2+>Br-.当通入有限量Cl2时.根据先后规律.Cl2首先将Fe2+氧化,但Cl2足量时.方可把Fe2+.Br-一并氧化.离子方程式可分别表示为: . . (5)价态归中规律: 如:KClO3 + 6HCl = KCl + 3Cl2↑+ 3H2O 不是KClO3 + 6HCl = KCl + 3Cl2↑+ 3H2O
网址:http://m.1010jiajiao.com/timu3_id_60628[举报]
(1)pH=2的两种一元酸HX和HY的溶液分别取50 mL,加入足量的镁粉,充分反应后,收集到H2的体积分别为V(HX)和V(HY),且V(HX)>V(HY)。则:?
①反应开始时两者生成H2的速率 。?
②等物质的量浓度的NaX和NaY溶液的碱性,NaX NaY(填“>”“<”或“=”);理由是:? ?。?
(2)某研究性学习小组的同学,取一定质量纯净的Na2SO3固体,隔绝空气600 ℃以上强热,得固体A,经测定强热前后固体质量保持不变。为进一步证明Na2SO3固体在强热条件下是否分解以及该条件下分解是否完全,他们对A进行如下实验:?

依据实验现象以及质量守恒定律和氧化还原反应的有关规律,他们推测固体A的成分可能是Na2SO4、Na2SO3、Na2S2O3、Na2S和Na2O中的数种,并且提出以下两种假设。?
试回答下列问题:?
假设1:①A溶液碱性比Na2SO3溶液碱性强,是由于生成的Na2S水解所致,则Na2SO3固体分解的化学反应方程式为: 。?
②若气体C是H2S,判断Na2SO3固体分解是否完全 (填“是”或“否”),你判断的理由是: 。?
假设2:③A溶液碱性比Na2SO3溶液碱性强,是由于生成的Na2O溶于水所致,则Na2SO3固体分解的化学反应方程式为:(未平配)?
□Na2SO3——□ Na2S2O3+□ Na2SO4+□ Na2O,请配平该化学反应方程式。?
④为进一步确定何种假设正确,该小组同学查阅有关资料得知,Na2S2O3不稳定,受热易分解,请你帮助判断上述何种假设正确 。?
查看习题详情和答案>> 硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应还原产物中氮的化合物越低.现有一定量的铝粉和铁粉的混合物与一定量很稀的HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1NaOH溶液.所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示:
硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应还原产物中氮的化合物越低.现有一定量的铝粉和铁粉的混合物与一定量很稀的HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1NaOH溶液.所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示:(1)和铝粉和铁粉的混合物反应时,HNO3对应还原产物为
NH4NO3
NH4NO3
(填化学式);(2)完成下列过程中的离子反应方程式:
O→C
H++OH-═H2O
H++OH-═H2O
;D→ENH4++OH-═NH3?H2O
NH4++OH-═NH3?H2O
;E→FAl(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
;(3)B值是多少mol?写出计算过程.
硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应还原产物中氮的化合价越低.现有一定量的铝粉和铁粉的混合物与一定量很稀HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐渐加入4mol/LNaOH溶液,所加NaOH溶液的体积(ml)与产生沉淀的物质的量(mol)关系如图所示.求:
(1)反应中硝酸的还原产物为
(2)B与A的差值:
(3)C的数值:

查看习题详情和答案>>
(1)反应中硝酸的还原产物为
硝酸铵
硝酸铵
(填名称).DE段是否发生了化学反应是
是
(填“是”或“否”).(2)B与A的差值:
0.008
0.008
mol; B的数值:0.032
0.032
mol.(写出计算过程)(3)C的数值:
7
7
ml.
铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒.有关含铬化合物的相互转化关系如下:

回答下列问题:
(1)上述转化关系中属于氧化还原反应的是
(2)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:
(3)由图示信息可知,有一种含铬化合物显两性,写出该化合物与NaOH溶液反应的离子方程式:
(4)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水.写出电极反应和溶液中进行的反应的离子方程式.阳极
(5)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,首先生成的沉淀是
查看习题详情和答案>>

回答下列问题:
(1)上述转化关系中属于氧化还原反应的是
①④⑧
①④⑧
(填编号),其中需要使用氧化剂的是④⑧
④⑧
(填编号).(2)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:
2CrO42-+2H+ Cr2O72-+H2O
Cr2O72-+H2O
 Cr2O72-+H2O
Cr2O72-+H2O2CrO42-+2H+ Cr2O72-+H2O
Cr2O72-+H2O
. Cr2O72-+H2O
Cr2O72-+H2O(3)由图示信息可知,有一种含铬化合物显两性,写出该化合物与NaOH溶液反应的离子方程式:
Cr(OH)3+OH-=CrO2-+2H2O
Cr(OH)3+OH-=CrO2-+2H2O
.(4)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水.写出电极反应和溶液中进行的反应的离子方程式.阳极
Fe-2e=Fe2+
Fe-2e=Fe2+
阴极2H++2e=H2↑
2H++2e=H2↑
溶液中6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O
6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O
.(5)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,首先生成的沉淀是
AgCl
AgCl
.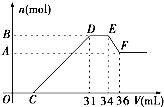 硝酸发生氧化还原反应的时候,一般硝酸越稀,对应的还原产物中氮的化合价越低.现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示.下列说法中不正确的是( )
硝酸发生氧化还原反应的时候,一般硝酸越稀,对应的还原产物中氮的化合价越低.现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示.下列说法中不正确的是( )| A、合金与硝酸反应时硝酸过量 | B、合金中铝的物质的量为0.008mol | C、合金中金属的物质的量共为0.032mol | D、无法求出C点的值 |