题目内容
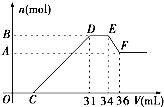
 硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应还原产物中氮的化合物越低.现有一定量的铝粉和铁粉的混合物与一定量很稀的HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1NaOH溶液.所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示:
硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应还原产物中氮的化合物越低.现有一定量的铝粉和铁粉的混合物与一定量很稀的HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1NaOH溶液.所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示:(1)和铝粉和铁粉的混合物反应时,HNO3对应还原产物为
NH4NO3
NH4NO3
(填化学式);(2)完成下列过程中的离子反应方程式:
O→C
H++OH-═H2O
H++OH-═H2O
;D→ENH4++OH-═NH3?H2O
NH4++OH-═NH3?H2O
;E→FAl(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
;(3)B值是多少mol?写出计算过程.
分析:(1)根据HNO3的还原产物有N2O,NO,NO2,NH4+等,以及反应的曲线变化硝酸的还原产物;
(2)O→C 之间没有沉淀生成,说明硝酸过量,O→C 之间发生的反应酸碱中和反应,D与E一段沉淀的质量没有发生变化,为NH4NO3和NaOH反应,E与F之间沉淀的量减少,为Al(OH)3溶解在氢氧化钠溶液中,以此书写离子方程式;
(3)根据曲线的变化判断出各段反应,根据消耗的氢氧化钠的体积和反应方程式计算反应后溶液含有铁离子和铝离子的物质的量,进而计算沉淀的总量.
(2)O→C 之间没有沉淀生成,说明硝酸过量,O→C 之间发生的反应酸碱中和反应,D与E一段沉淀的质量没有发生变化,为NH4NO3和NaOH反应,E与F之间沉淀的量减少,为Al(OH)3溶解在氢氧化钠溶液中,以此书写离子方程式;
(3)根据曲线的变化判断出各段反应,根据消耗的氢氧化钠的体积和反应方程式计算反应后溶液含有铁离子和铝离子的物质的量,进而计算沉淀的总量.
解答:解:(1)HNO3的还原产物有N2O,NO,NO2,NH4+等,其中,铵根可以保留在溶液中,且可以与氢氧化钠反应,D与E一段氢氧化钠被消耗,但没有和氢氧化铝反应,从题干中可以知道,硝酸反应没有气体产生,由此可以肯定还原产物为硝酸铵.
故答案为:NH4NO3;
(2)O→C 之间没有沉淀生成,说明硝酸过量,O→C 之间发生的反应酸碱中和反应,离子方程式为H++OH-═H2O,
D与E一段沉淀的质量没有发生变化,为NH4NO3和NaOH反应,反应的离子方程式为,NH4++OH-═NH3?H2O,
E与F之间沉淀的量减少,肯定是因为Al(OH)3溶解在氢氧化钠溶液中,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O
故答案为:H++OH-═H2O;NH4++OH-═NH3?H2O;Al(OH)3+OH-=AlO2-+2H2O;
(3)E与F之间沉淀的量减少,为Al(OH)3溶解在氢氧化钠溶液中,
其反应方程式为Al(OH)3+NaOH=NaAlO2+2H2O,
氢氧化铝与氢氧化钠物质的量之比为1:1,
EF段的n(NaOH)=4mol/L×2×10-3L=0.008mol,
Al(OH)3+NaOH→NaAlO2+2H2O
1 mol 1mol
0.008 mol 0.008mol
Al(OH)3的量是0.008mol,所以Al3+也是0.008mol.
所以B与A差值为0.008mol
然后看D与E一段氢氧化钠被消耗,
但没有和氢氧化铝反应,从题干中可以知道
硝酸反应没有气体产生,由此可以肯定还原产物为硝酸铵.
DE段分析如下,是NH4NO3和NaOH反应
NH4NO3~NaOH
1 mol 1mol
n(NH4NO3)=n(NaOH)=(34-31)×10-3L×4mol/L=0.012mol 所以铁和铝开始和硝酸反应的时候生成三价离子,N元素变成铵根离子
铁离子和铝离子失去3e,N元素从+5变成-3价得8e
设铁有xmol,Al离子也是0.008mol,NH4+有0.012mol,根据电子守恒可得:
3x+0.008×3=0.012×8
x=0.024mol,
所以铁离子有0.024mol,那么氢氧化铁有0.024mol,氢氧化铝0.008mol,
则沉淀量最多的时候是0.032mol,
答:B值是0.032mol.
故答案为:NH4NO3;
(2)O→C 之间没有沉淀生成,说明硝酸过量,O→C 之间发生的反应酸碱中和反应,离子方程式为H++OH-═H2O,
D与E一段沉淀的质量没有发生变化,为NH4NO3和NaOH反应,反应的离子方程式为,NH4++OH-═NH3?H2O,
E与F之间沉淀的量减少,肯定是因为Al(OH)3溶解在氢氧化钠溶液中,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O
故答案为:H++OH-═H2O;NH4++OH-═NH3?H2O;Al(OH)3+OH-=AlO2-+2H2O;
(3)E与F之间沉淀的量减少,为Al(OH)3溶解在氢氧化钠溶液中,
其反应方程式为Al(OH)3+NaOH=NaAlO2+2H2O,
氢氧化铝与氢氧化钠物质的量之比为1:1,
EF段的n(NaOH)=4mol/L×2×10-3L=0.008mol,
Al(OH)3+NaOH→NaAlO2+2H2O
1 mol 1mol
0.008 mol 0.008mol
Al(OH)3的量是0.008mol,所以Al3+也是0.008mol.
所以B与A差值为0.008mol
然后看D与E一段氢氧化钠被消耗,
但没有和氢氧化铝反应,从题干中可以知道
硝酸反应没有气体产生,由此可以肯定还原产物为硝酸铵.
DE段分析如下,是NH4NO3和NaOH反应
NH4NO3~NaOH
1 mol 1mol
n(NH4NO3)=n(NaOH)=(34-31)×10-3L×4mol/L=0.012mol 所以铁和铝开始和硝酸反应的时候生成三价离子,N元素变成铵根离子
铁离子和铝离子失去3e,N元素从+5变成-3价得8e
设铁有xmol,Al离子也是0.008mol,NH4+有0.012mol,根据电子守恒可得:
3x+0.008×3=0.012×8
x=0.024mol,
所以铁离子有0.024mol,那么氢氧化铁有0.024mol,氢氧化铝0.008mol,
则沉淀量最多的时候是0.032mol,
答:B值是0.032mol.
点评:解题是注意两点:1.有两种金属,铝和铁,其中氢氧化铝具有两性,2.HNO3的还原产物有N2O,NO,NO2,NH4+等,其中,铵根可以保留在溶液中,且可以与氢氧化钠反应.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
 硝酸发生氧化还原反应的时候,一般硝酸越稀,对应的还原产物中氮的化合价越低.现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示.下列说法中不正确的是( )
硝酸发生氧化还原反应的时候,一般硝酸越稀,对应的还原产物中氮的化合价越低.现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示.下列说法中不正确的是( )| A、合金与硝酸反应时硝酸过量 | B、合金中铝的物质的量为0.008mol | C、合金中金属的物质的量共为0.032mol | D、无法求出C点的值 |

