摘要:(1)小.工业制备硫酸. (2)MnO2 + 2Fe2+ + 4H+ = Mn2+ + 2Fe3+ + 2H2O. 使Fe2+ 转变为Fe3+.Fe3+完全沉淀的pH较低(或Fe3+更易沉淀). (3)与溶液中的酸反应.使溶液中的Fe3+.Al3+转化为氢氧化物沉淀. (4)使MnCO3沉淀完全.MnCO3沉淀量少.NH4HCO3与酸反应.(或MnCO3.NH4HCO3与酸反应溶解) (5)节约能源.治理含SO2的工业废气等.
网址:http://m.1010jiajiao.com/timu3_id_60264[举报]
(2011?常州三模)碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业.一种制备MnCO3的生产流程如图所示.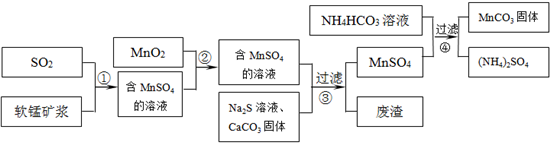
已知生成氢氧化物的pH和有关硫化物的Ksp如下表:
软锰矿主要成分为MnO2,其中含有铁、铝、硅的氧化物和少量重金属化合物杂质,SO2来自工业废气.流程①中主要发生的反应有:MnO2+SO2=MnSO4 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(1)流程①中所得MnSO4溶液的pH比软锰矿浆的pH
(2)反应②的目的是将溶液中的Fe2+氧化成Fe3+,其离子反应方程式为
(3)反应③中硫化钠的作用是使重金属离子转化为硫化物沉淀,碳酸钙的作用是
(4)反应④发生的化学反应为:MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O.
反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4.加入稍过量的NH4HCO3的目的是
(5)软锰矿中锰的浸出有两种工艺:
工艺A:软锰矿浆与含SO2的工业废气反应 工艺B:软锰矿与煤炭粉混合,焙烧后加稀硫酸溶解.
其中工艺A的优点是
查看习题详情和答案>>

已知生成氢氧化物的pH和有关硫化物的Ksp如下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
| 物质 | MnS | CuS | PbS |
| Ksp | 2.5×10-13 | 6.3×10-36 | 8.0×10-28 |
(1)流程①中所得MnSO4溶液的pH比软锰矿浆的pH
小
小
(填“大”或“小”),该流程可与工业制备硫酸
工业制备硫酸
(填工业生产名称)联合,生产效益更高.(2)反应②的目的是将溶液中的Fe2+氧化成Fe3+,其离子反应方程式为
MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
,这样设计的目的和原理是使Fe2+转变为Fe3+,Fe3+完全沉淀的pH较低(或Fe3+更易沉淀)
使Fe2+转变为Fe3+,Fe3+完全沉淀的pH较低(或Fe3+更易沉淀)
(3)反应③中硫化钠的作用是使重金属离子转化为硫化物沉淀,碳酸钙的作用是
与溶液中的酸反应,使溶液中的Fe3+、Al3+转化为氢氧化物沉淀
与溶液中的酸反应,使溶液中的Fe3+、Al3+转化为氢氧化物沉淀
.(4)反应④发生的化学反应为:MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O.
反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4.加入稍过量的NH4HCO3的目的是
使MnCO3沉淀完全
使MnCO3沉淀完全
,溶液的pH不能过低的原因是MnCO3沉淀量少,NH4HCO3与酸反应
MnCO3沉淀量少,NH4HCO3与酸反应
.(5)软锰矿中锰的浸出有两种工艺:
工艺A:软锰矿浆与含SO2的工业废气反应 工艺B:软锰矿与煤炭粉混合,焙烧后加稀硫酸溶解.
其中工艺A的优点是
节约能源、治理含SO2的工业废气等
节约能源、治理含SO2的工业废气等
.(答对1个即可)下列说法正确的是( )
| A、棉花、羊毛、木材和草类的主要成分都是纤维类 | B、乙醇是可再生能源,而且比汽油污染小,应大力推广乙醇汽油 | C、光导纤维非常细,导光能力非常强,能同时传输大量信息,光导纤维是由硅晶体制成的 | D、工业制备硫酸的尾气中,常含有SO2等有害气体,如果直接排入大气,可能形成光化学烟雾 |
工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2,微量的SO3和酸雾.为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品.请按要求回答下列问题:
(1)工业制备硫酸时硫铁矿燃烧的设备是
(2)将尾气通入氨水中,能发生多个反应,写出其中可能发生的任意一个氧化还原反应的化学方程式:
(3)能用于测定硫酸尾气中SO2含量的是
A.NaOH溶液、酚酞试液
B.KMn04溶液、稀H2SO4
C.碘水、淀粉溶液
D.氨水、酚酞试液
(4)在制各硫酸的过程中,对废液、废热和废渣的处理正确的是:.
a.污水用石灰乳处理
b.废渣用来造水泥、炼铁
c.设置“废热”锅炉产生蒸气来供热或发电.
查看习题详情和答案>>
(1)工业制备硫酸时硫铁矿燃烧的设备是
沸腾炉
沸腾炉
,反应的化学方程式为4FeS2+11O2
2Fe2O3+8SO2
| ||
4FeS2+11O2
2Fe2O3+8SO2
.
| ||
(2)将尾气通入氨水中,能发生多个反应,写出其中可能发生的任意一个氧化还原反应的化学方程式:
2(NH4)2SO3+O2═2(NH4)2SO4或2NH4HSO3+O2═2NH4HSO4;
2(NH4)2SO3+O2═2(NH4)2SO4或2NH4HSO3+O2═2NH4HSO4;
.(3)能用于测定硫酸尾气中SO2含量的是
BC
BC
.(填字母)A.NaOH溶液、酚酞试液
B.KMn04溶液、稀H2SO4
C.碘水、淀粉溶液
D.氨水、酚酞试液
(4)在制各硫酸的过程中,对废液、废热和废渣的处理正确的是:.
a.污水用石灰乳处理
b.废渣用来造水泥、炼铁
c.设置“废热”锅炉产生蒸气来供热或发电.
【化学-选修化学与技术】
重晶石矿石主要含有BaSO4,还含有少量有SiO2、Al2O3、Fe2O3、MnO2、FeS2、Na2O、K2O等杂质.以下是某工业制备硫酸钡以及分离某些金属的流程图.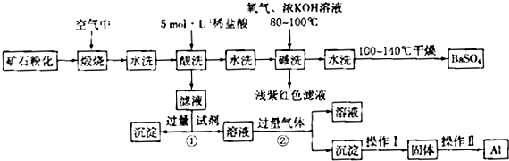
(1)煅烧过程中产生的污染性气体主要是 .
(2)确定第一次水洗液中有K+存在的实验现象是 .
(3)写出碱洗时的氧化还原反应方程式 .
(4)①反应生成沉淀的化学式 ,②反应的离子方程式为 .
(5)操作I为 ,操作II为 .
查看习题详情和答案>>
重晶石矿石主要含有BaSO4,还含有少量有SiO2、Al2O3、Fe2O3、MnO2、FeS2、Na2O、K2O等杂质.以下是某工业制备硫酸钡以及分离某些金属的流程图.

(1)煅烧过程中产生的污染性气体主要是
(2)确定第一次水洗液中有K+存在的实验现象是
(3)写出碱洗时的氧化还原反应方程式
(4)①反应生成沉淀的化学式
(5)操作I为
下图所示的装置是仿照工业制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫。
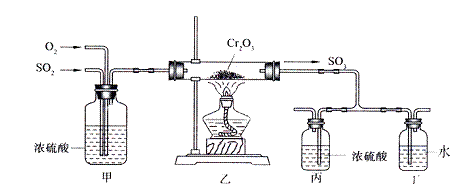
试填写下列空白:
(1)写出工业上用FeS2制取SO2的化学方程式 。
(2)写出上图中部分装置的作用:甲:①混合SO2和O2;② ;
丙和丁: 。
(3)若丁装置在反应过程中出现气泡,不久就出现了白雾,而丙装置一直没有明显变化,产生这种现象的可能原因是:①丙中插入浓硫酸溶液的导管插得太深,使两个吸收瓶内的压强差较大,导致SO3从丁的水中冒了出来,与水形成酸雾;
②
(4)上图装置中的甲和乙部分、丙和丁部分分别与工业制取硫酸的装置相对应,甲和乙相当于 ;丙和丁相当于 。
(5)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都正确的是 (填下列各项的序号)。
A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能在空气中燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
查看习题详情和答案>>