题目内容
【化学-选修化学与技术】
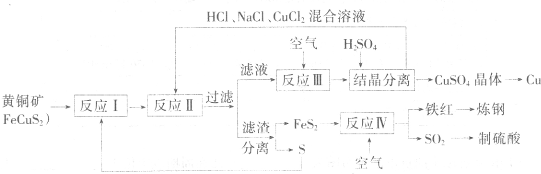
重晶石矿石主要含有BaSO4,还含有少量有SiO2、Al2O3、Fe2O3、MnO2、FeS2、Na2O、K2O等杂质.以下是某工业制备硫酸钡以及分离某些金属的流程图.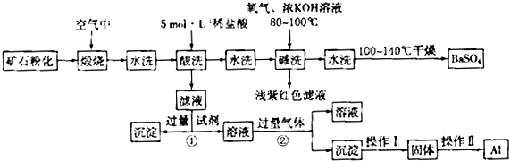
(1)煅烧过程中产生的污染性气体主要是 .
(2)确定第一次水洗液中有K+存在的实验现象是 .
(3)写出碱洗时的氧化还原反应方程式 .
(4)①反应生成沉淀的化学式 ,②反应的离子方程式为 .
(5)操作I为 ,操作II为 .
重晶石矿石主要含有BaSO4,还含有少量有SiO2、Al2O3、Fe2O3、MnO2、FeS2、Na2O、K2O等杂质.以下是某工业制备硫酸钡以及分离某些金属的流程图.

(1)煅烧过程中产生的污染性气体主要是
(2)确定第一次水洗液中有K+存在的实验现象是
(3)写出碱洗时的氧化还原反应方程式
(4)①反应生成沉淀的化学式
(5)操作I为
分析:(1)FeS2燃烧生成二氧化硫;
(2)焰色反应中透过蓝色钴玻璃观察到火焰呈紫色;
(3)二氧化锰与氧气和氢氧化钾反应生成KMnO4和H2O;
(4)三价铁离子和碱液生成氢氧化铁,碳酸酸性大于氢氧化铝;
(5)氢氧化铝分解生成氧化铝,氧化铝电解得到铝单质.
(2)焰色反应中透过蓝色钴玻璃观察到火焰呈紫色;
(3)二氧化锰与氧气和氢氧化钾反应生成KMnO4和H2O;
(4)三价铁离子和碱液生成氢氧化铁,碳酸酸性大于氢氧化铝;
(5)氢氧化铝分解生成氧化铝,氧化铝电解得到铝单质.
解答:解:(1)煅烧过程中产生的污染性气体主要是SO2,故答案为SO2;
(2)检验K+的实验方法是:焰色反应中透过蓝色钴玻璃观察到火焰呈紫色,故答案为:焰色反应中透过蓝色钴玻璃观察到火焰呈紫色;
(3)碱洗时的氧化还原反应方程式:4MnO2+3O2+4KOH
4KMnO4+2H2O,故答案为:4MnO2+3O2+4KOH
4KMnO4+2H2O;
(4)三价铁离子和碱液生成Fe (OH)3,②强酸反应制弱酸,反应的离子方程式为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故答案为:Fe (OH)3;AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
(5)氢氧化铝分解生成氧化铝,氧化铝电解得到铝单质,故操作Ⅰ为加热,操作Ⅱ为电解,故答案为:加热;电解.
(2)检验K+的实验方法是:焰色反应中透过蓝色钴玻璃观察到火焰呈紫色,故答案为:焰色反应中透过蓝色钴玻璃观察到火焰呈紫色;
(3)碱洗时的氧化还原反应方程式:4MnO2+3O2+4KOH
| ||
| ||
(4)三价铁离子和碱液生成Fe (OH)3,②强酸反应制弱酸,反应的离子方程式为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故答案为:Fe (OH)3;AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
(5)氢氧化铝分解生成氧化铝,氧化铝电解得到铝单质,故操作Ⅰ为加热,操作Ⅱ为电解,故答案为:加热;电解.
点评:本题考查无机框图题,题目难度不大,明确物质间的反应是解题的关键.

练习册系列答案
相关题目