题目内容
下图所示的装置是仿照工业制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫。
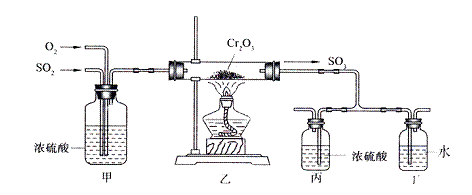
试填写下列空白:
(1)写出工业上用FeS2制取SO2的化学方程式 。
(2)写出上图中部分装置的作用:甲:①混合SO2和O2;② ;
丙和丁: 。
(3)若丁装置在反应过程中出现气泡,不久就出现了白雾,而丙装置一直没有明显变化,产生这种现象的可能原因是:①丙中插入浓硫酸溶液的导管插得太深,使两个吸收瓶内的压强差较大,导致SO3从丁的水中冒了出来,与水形成酸雾;
②
(4)上图装置中的甲和乙部分、丙和丁部分分别与工业制取硫酸的装置相对应,甲和乙相当于 ;丙和丁相当于 。
(5)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都正确的是 (填下列各项的序号)。
A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能在空气中燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
(1)4FeS2 + 11O2 ![]() 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2
(2)②干燥SO2和O2(或“观察通入SO2和O2体积比”);吸收SO3并做对照实验
(3)②浓硫酸对SO3的吸收效果远好于水,SO3充分被浓硫酸吸收
(4)接触室;吸收塔。
(5)D

 名校课堂系列答案
名校课堂系列答案