摘要:25.答案: -77.6 kJ·mol-1. 2,2NH3·H2O+Cu2+=Cu(OH)2↓+2NH4+ , (4)中,mol·L-1 [解析](1)恒温.恒压条件下向平恒体系中通入氩气.使总体积增大.相当于稀释原体系.平衡左移,使用催化剂只是改变了反应的途径.没有改变反应物与生成物的状态.DH不变, (2)利用盖斯定律.DH1+DH2+(-DH3) = -78.2 kJ·mol-1, (3)由于.KsP[Cu(OH)2]<Ksp[Mg(OH)2].所以先生成Cu(OH)2沉淀, (4)根据电荷守恒:c(NH4+ )+c(H+) = c(Cl-)+c(OH-).现c(NH4+ ) = c(Cl-).必有c(H+) = c(OH-).故溶液显中性. Kb = .c(NH4+ ) = c(Cl-)=0.005 mol·L-1,c(H+)=c(OH-)=1×10-7 mol·L-1(因为是25 ℃下且为中性),c(N H3·H2O)=(-0.005) mol·L-1.所以:Kb = mol·L-1. () 来源: 版权所有:() 版权所有:() 版权所有:()
网址:http://m.1010jiajiao.com/timu3_id_60026[举报]
向2L固定容积的密闭容器中加入一定量的NH3,H2和N2三种气体.一定条件下发生反应2NH3?N2+3H2,各物质浓度随时间变化如图1所示.图2为t时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且两个阶段各改变一种不同的条件.
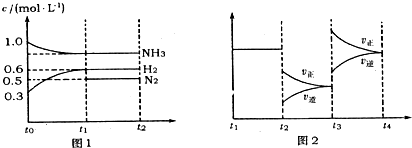
(1)能证明反应达到平衡状态的是
A.容器内压强不再发生变化 B.N2的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
(2)若tl=15s,则t0-t1阶段以H2浓度变化表示的反应速率为
(3)t3-t4阶段改变的条件为
(4)上述反应的平衡常数K=
(5)25℃时,将a mol?L-1的氨水与0.1mol?L-1的盐酸等体积混合.
①当溶液中离子浓度关系满足c(NH4+)<c(Cl-)时,则反应的情况可能为
a.盐酸不足,氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3?H2O的电离常数Kb=
.
查看习题详情和答案>>

(1)能证明反应达到平衡状态的是
AB
AB
(填标号,下同).A.容器内压强不再发生变化 B.N2的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
(2)若tl=15s,则t0-t1阶段以H2浓度变化表示的反应速率为
0.02mol/(L?min)
0.02mol/(L?min)
.(3)t3-t4阶段改变的条件为
升高温度
升高温度
.(4)上述反应的平衡常数K=
0.17
0.17
(保留两位小数);向容器中再通入1.4molNH3、0.8molH2,平衡向左
向左
移动(填“向右”、“向左”或“不移动”).(5)25℃时,将a mol?L-1的氨水与0.1mol?L-1的盐酸等体积混合.
①当溶液中离子浓度关系满足c(NH4+)<c(Cl-)时,则反应的情况可能为
abc
abc
a.盐酸不足,氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3?H2O的电离常数Kb=
| 10-8 |
| a-0.1 |
| 10-8 |
| a-0.1 |
反应C(s)+H2O(g)?CO(g)+H2(g)在可变容积的密闭容器中进行,达到平衡后发生下列改变,对化学反应速率和化学平衡有何影响?
①容器的体积缩小一半,反应速率
②保持体积不变,充入N2,使体系的压强增大一倍,反应速率
③保持压强不变充入N2,反应速率
查看习题详情和答案>>
①容器的体积缩小一半,反应速率
增大
增大
(填“增大”、“减小”或“不变”,下同);平衡向左
向左
移动(填“向右”、“向左”或“不移动”,下同).②保持体积不变,充入N2,使体系的压强增大一倍,反应速率
不变
不变
;平衡不
不
移动③保持压强不变充入N2,反应速率
减小
减小
;平衡向右
向右
移动. (2010?烟台一模)某温度时,在一容积为1L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,5min时达到平衡,反应中NH3的物质的量浓度的变化情况如图所示:请回答下列问题:(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N2)=
(2010?烟台一模)某温度时,在一容积为1L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,5min时达到平衡,反应中NH3的物质的量浓度的变化情况如图所示:请回答下列问题:(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N2)=0.02mol?L-1?min-1
0.02mol?L-1?min-1
.(2)该反应的化学平衡常数表达式为
| c(NH3)2 |
| c(N2).c(H2)3 |
| c(NH3)2 |
| c(N2).c(H2)3 |
(3)反应达到平衡后,第5min末保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
ac
ac
(填序号)a.0.82mol?L-1 b.0.25mol?L-1 c.0.20mol?L-1 d.0.08mol?L-1
(4)反应达到平衡后,第5min末保持其他条件不变,若只把容器的体积缩小一半,平衡
向右
向右
移动(填“向右”、“向左”或“不”),化学平衡常数不变
不变
(填“增大”、“减少”或“不变”).(5)其它条件不变,在第5min末将容器的体积缩小一半,若第8min达到新的平衡(此时NH3的物质的量约为0.25mol),请在上图中画出第5min末到此平衡时NH3物质的量浓度的变化曲线.
(l4分)向2L固定容积的密闭容器中加入一定量的NH3,H2和N2三种气体。一定条件下发生反应2NH3 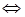 N2+3H2,各物质浓度随时间变化如图1所示。图2为t时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且两个阶段各改变一种不同的条件。
N2+3H2,各物质浓度随时间变化如图1所示。图2为t时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且两个阶段各改变一种不同的条件。
(1)能证明反应达到平衡状态的是 (填标号,下同)。
A.容器内压强不再发生变化 B. N2的体积分数不再发生变化
C. 容器内气体质量不再发生变化 D. 容器内气体密度不再发生变化
(2)若tl=15 s,则t0-t1阶段以H2浓度变化表示的反应速率为 。
(3)t3-t4阶段改变的条件为 。
(4)上述反应的平衡常数K= (保留两位小数);向容器中再通入1.4molNH3、0.8 molH2,平衡 移动(填“向右”、“向左”或“不移动”)。
(5)25OC时,将a mol·L-1的氨水与0.1 mol·L-1的盐酸等体积混合。
①当溶液中离子浓度关系满足c(NH4+)<c(Cl-)时,则反应的情况可能为
a.盐酸不足,氨水剩余 b. 氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb= 。
查看习题详情和答案>>
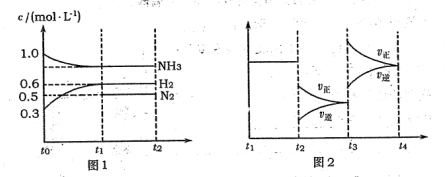
向2L固定容积的密闭容器中加入一定量的NH3,H2和N2三种气体.一定条件下发生反应2NH3?N2+3H2,各物质浓度随时间变化如图1所示.图2为t时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且两个阶段各改变一种不同的条件.
(1)能证明反应达到平衡状态的是 (填标号,下同).
A.容器内压强不再发生变化 B.N2的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
(2)若tl=15s,则t-t1阶段以H2浓度变化表示的反应速率为 .
(3)t3-t4阶段改变的条件为 .
(4)上述反应的平衡常数K= (保留两位小数);向容器中再通入1.4molNH3、0.8molH2,平衡 移动(填“向右”、“向左”或“不移动”).
(5)25℃时,将a mol?L-1的氨水与0.1mol?L-1的盐酸等体积混合.
①当溶液中离子浓度关系满足c(NH4+)<c(Cl-)时,则反应的情况可能为
a.盐酸不足,氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3?H2O的电离常数Kb= . 查看习题详情和答案>>

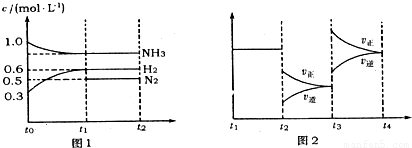
(1)能证明反应达到平衡状态的是 (填标号,下同).
A.容器内压强不再发生变化 B.N2的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
(2)若tl=15s,则t-t1阶段以H2浓度变化表示的反应速率为 .
(3)t3-t4阶段改变的条件为 .
(4)上述反应的平衡常数K= (保留两位小数);向容器中再通入1.4molNH3、0.8molH2,平衡 移动(填“向右”、“向左”或“不移动”).
(5)25℃时,将a mol?L-1的氨水与0.1mol?L-1的盐酸等体积混合.
①当溶液中离子浓度关系满足c(NH4+)<c(Cl-)时,则反应的情况可能为
a.盐酸不足,氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3?H2O的电离常数Kb= . 查看习题详情和答案>>