题目内容
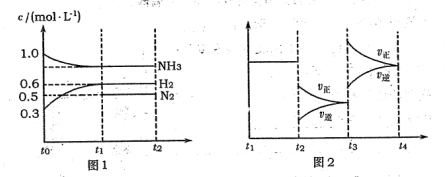
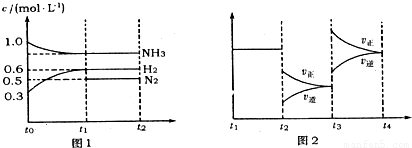
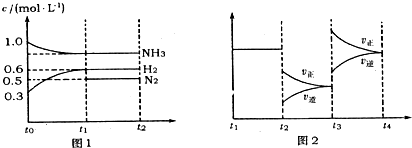
向2L固定容积的密闭容器中加入一定量的NH3,H2和N2三种气体.一定条件下发生反应2NH3?N2+3H2,各物质浓度随时间变化如图1所示.图2为t时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且两个阶段各改变一种不同的条件.
(1)能证明反应达到平衡状态的是
A.容器内压强不再发生变化 B.N2的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
(2)若tl=15s,则t0-t1阶段以H2浓度变化表示的反应速率为
(3)t3-t4阶段改变的条件为
(4)上述反应的平衡常数K=
(5)25℃时,将a mol?L-1的氨水与0.1mol?L-1的盐酸等体积混合.
①当溶液中离子浓度关系满足c(NH4+)<c(Cl-)时,则反应的情况可能为
a.盐酸不足,氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3?H2O的电离常数Kb=
.

(1)能证明反应达到平衡状态的是
AB
AB
(填标号,下同).A.容器内压强不再发生变化 B.N2的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
(2)若tl=15s,则t0-t1阶段以H2浓度变化表示的反应速率为
0.02mol/(L?min)
0.02mol/(L?min)
.(3)t3-t4阶段改变的条件为
升高温度
升高温度
.(4)上述反应的平衡常数K=
0.17
0.17
(保留两位小数);向容器中再通入1.4molNH3、0.8molH2,平衡向左
向左
移动(填“向右”、“向左”或“不移动”).(5)25℃时,将a mol?L-1的氨水与0.1mol?L-1的盐酸等体积混合.
①当溶液中离子浓度关系满足c(NH4+)<c(Cl-)时,则反应的情况可能为
abc
abc
a.盐酸不足,氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3?H2O的电离常数Kb=
| 10-8 |
| a-0.1 |
| 10-8 |
| a-0.1 |
分析:(1)达到平衡状态时,正逆反应速率相等,各物质的浓度不变,百分含量不变,以及由此衍生的其它一些量不变,据此分析;
(2)由图可知,t0-t1阶段H2浓度变化量为0.6mol/L-0.3mol/L=0.3mol/L,根据v=
计算v(H2);
(3)由图可知,t3时刻瞬间正、逆速率都增大,且正反应速率增大更多,平衡向正反应方向移动,结合温度、压强对平衡的影响分析;
(4)由图1可知,平衡时氢气、氮气的浓度,计算氨气的平衡浓度,代入平衡常数表达式计算;
计算此时的浓度商,与平衡常数比较,判断反应进行方向;
(5)①溶液中离子浓度关系满足c(NH4+)<c(Cl-)时,由电荷守恒可知c(H+)>c(OH-),溶液呈酸性性,结合选项根据反应物量的关系,判断溶液酸碱性;
②根据电荷守恒判断溶液中氢离子与氢氧根离子浓度的相对大小,进而判断溶液的酸碱性;
溶液中存在平衡NH3.H2O?NH4++OH-,根据溶液的pH值计算溶液中c(OH-),根据氯离子浓度计算c(NH4+),利用物料守恒计算溶液中c(NH3.H2O),代入NH3?H2O的电离常数表达式计算.
(2)由图可知,t0-t1阶段H2浓度变化量为0.6mol/L-0.3mol/L=0.3mol/L,根据v=
| △c |
| △t |
(3)由图可知,t3时刻瞬间正、逆速率都增大,且正反应速率增大更多,平衡向正反应方向移动,结合温度、压强对平衡的影响分析;
(4)由图1可知,平衡时氢气、氮气的浓度,计算氨气的平衡浓度,代入平衡常数表达式计算;
计算此时的浓度商,与平衡常数比较,判断反应进行方向;
(5)①溶液中离子浓度关系满足c(NH4+)<c(Cl-)时,由电荷守恒可知c(H+)>c(OH-),溶液呈酸性性,结合选项根据反应物量的关系,判断溶液酸碱性;
②根据电荷守恒判断溶液中氢离子与氢氧根离子浓度的相对大小,进而判断溶液的酸碱性;
溶液中存在平衡NH3.H2O?NH4++OH-,根据溶液的pH值计算溶液中c(OH-),根据氯离子浓度计算c(NH4+),利用物料守恒计算溶液中c(NH3.H2O),代入NH3?H2O的电离常数表达式计算.
解答:解:(1)发生反应为2NH3(g)?N2(g)+3H2(g)△H>0,
A.随反应进行容器内压强增大,容器内压强不再发生变化,说明到达平衡,故A正确;
B.平衡时各组分的含量不变,N2的体积分数不再发生变化,说明到达平衡,故B正确;
C.容器内气体质量始终不发生变化,故C错误;
D.容器内混合气体的总质量不变,容器的容积不变,容器内气体密度始终不发生变化,故D错误;
故选:AB;
(2)由图可知,t0-t1阶段H2浓度变化量为0.6mol/L-0.3mol/L=0.3mol/L,故v(H2)=
=0.02mol/(L?min),
故答案为:0.02mol/(L?min);
(3)由图可知,t3时刻瞬间正、逆速率都增大,且正反应速率增大更多,平衡向正反应方向移动,正反应为气体体积增大的吸热反应,增大压强平衡向逆反应方向移动,升高温度平衡向正反应方向移动,故改变的条件应是:升高温度,
故答案为:升高温度;
(4)由图1可知,平衡时氢气、氮气的浓度分别为0.6mol/L、0.5mol/L,故平衡时氨气的浓度为1mol/L-
×
0.3mol/L=0.8mol/L,故平衡常数K=
=0.17;
向容器中再通入1.4molNH3、0.8molH2,氨气浓度变为(0.8+
)mol/L=1.5mol/L,氢气的浓度变为(0.6+
)mol/L=1mol/L,故浓度商Qc=
=0.22>0.17,平衡向左移动,
故答案为:0.17;向左;
(5)①溶液中离子浓度关系满足c(NH4+)<c(Cl-)时,由电荷守恒可知c(H+)>c(OH-),溶液呈酸性性,
a.盐酸不足,氨水剩余,为氯化铵与氨水的混合溶液,铵根离子水解程度大于氨水的电离时,溶液可能呈酸性,故a可能;
b.氨水与盐酸恰好完全反应,为氯化铵溶液,铵根离子水解,溶液呈酸性,故b可能;
c.盐酸过量,溶液为氯化铵、盐酸的混合溶液,溶液呈酸性,故c可能;
故选:abc;
②根据电荷守恒有c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于c(NH4+)=c(Cl-),故c(H+)=c(OH-),溶液呈中性,故溶液中c(OH-)=10-7mol/L,溶液中c(NH4+)=c(Cl-)=
×0.1mol?L-1=0.05mol?L-1,故混合后溶液中c(NH3.H2O)=
×amol?L-1-0.05mol?L-1=(0.5a-0.05)mol/L,NH3?H2O的电离常数Kb=
=
,
故答案为:
.
A.随反应进行容器内压强增大,容器内压强不再发生变化,说明到达平衡,故A正确;
B.平衡时各组分的含量不变,N2的体积分数不再发生变化,说明到达平衡,故B正确;
C.容器内气体质量始终不发生变化,故C错误;
D.容器内混合气体的总质量不变,容器的容积不变,容器内气体密度始终不发生变化,故D错误;
故选:AB;
(2)由图可知,t0-t1阶段H2浓度变化量为0.6mol/L-0.3mol/L=0.3mol/L,故v(H2)=
| 0.3mol/L |
| 15s |
故答案为:0.02mol/(L?min);
(3)由图可知,t3时刻瞬间正、逆速率都增大,且正反应速率增大更多,平衡向正反应方向移动,正反应为气体体积增大的吸热反应,增大压强平衡向逆反应方向移动,升高温度平衡向正反应方向移动,故改变的条件应是:升高温度,
故答案为:升高温度;
(4)由图1可知,平衡时氢气、氮气的浓度分别为0.6mol/L、0.5mol/L,故平衡时氨气的浓度为1mol/L-
| 2 |
| 3 |
0.3mol/L=0.8mol/L,故平衡常数K=
| 0.63×0.5 |
| 0.82 |
向容器中再通入1.4molNH3、0.8molH2,氨气浓度变为(0.8+
| 1.4 |
| 2 |
| 0.8 |
| 2 |
| 13×0.5 |
| 1.52 |
故答案为:0.17;向左;
(5)①溶液中离子浓度关系满足c(NH4+)<c(Cl-)时,由电荷守恒可知c(H+)>c(OH-),溶液呈酸性性,
a.盐酸不足,氨水剩余,为氯化铵与氨水的混合溶液,铵根离子水解程度大于氨水的电离时,溶液可能呈酸性,故a可能;
b.氨水与盐酸恰好完全反应,为氯化铵溶液,铵根离子水解,溶液呈酸性,故b可能;
c.盐酸过量,溶液为氯化铵、盐酸的混合溶液,溶液呈酸性,故c可能;
故选:abc;
②根据电荷守恒有c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于c(NH4+)=c(Cl-),故c(H+)=c(OH-),溶液呈中性,故溶液中c(OH-)=10-7mol/L,溶液中c(NH4+)=c(Cl-)=
| 1 |
| 2 |
| 1 |
| 2 |
| 10-7×0.05 |
| 0.5a-0.05 |
| 10-8 |
| a-0.1 |
故答案为:
| 10-8 |
| a-0.1 |
点评:本题考查化学平衡图象、化学平衡有关计算、影响化学平衡的因素、溶液酸碱性判断、电离平衡常数计算等,是对知识的综合运用,难度中等,(5)中注意离子浓度的计算.

练习册系列答案
相关题目
(l4分)向2L固定容积的密闭容器中加入一定量的NH3,H2和N2三种气体。一定条件下发生反应2NH3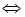 N2+3H2,各物质浓度随时间变化如图1所示。图2为t时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且两个阶段各改变一种不同的条件。
N2+3H2,各物质浓度随时间变化如图1所示。图2为t时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且两个阶段各改变一种不同的条件。
(1)能证明反应达到平衡状态的是 (填标号,下同)。
| A.容器内压强不再发生变化 | B.N2的体积分数不再发生变化 |
| C.容器内气体质量不再发生变化 | D.容器内气 体密度不再发生变化 体密度不再发生变化 |
(3)t3-t4阶段改变的条件为 。
(4)上述反应的平衡常数K= (保留两位小数);向容器中再通入1.4molNH3、0.8 molH2,平衡 移动(填“向右”、“向左”或“不移动”)。
(5)25OC时,将a mol·L-1的氨水与0.1 mol·L-1的盐酸等体积混合。
①当溶液中离子浓度关系满足c(NH4+)<c(Cl-)时,则反应的情况可能为
a.盐酸不足,氨水剩余 b. 氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb=
 。
。  N2+3H2,各物质浓度随时间变化如图1所示。图2为t时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且两个阶段各改变一种不同的条件。
N2+3H2,各物质浓度随时间变化如图1所示。图2为t时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且两个阶段各改变一种不同的条件。