摘要:9.答案:(1)MnO2+4H++2Cl-Mn2++Cl2↑+2H2O. (2)平衡压强(或使分液漏斗中的压强与圆底烧瓶中的压强相同.便于盐酸流下) 浓硫酸 使SiCl4冷凝. (3)Al.P.Cl. (4)①否,KMnO4溶液自身可作指示剂. ②4.480%. [解析]先理解各装置的用途.本实验目的是制备四氯化硅.根据题意.要用原料Cl2和粗Si.A装置为Cl2的制备装置(浓HCl与MnO2),B装置除HCl,C装置(浓H2SO4)干燥Cl2(SiCl4遇水极易水解.所以D装置中不能有水蒸气),D装置发生Cl2与铁.铝.硼.磷的反应,E装置使SiCl4冷凝(也使升华后的AlCl3.FeCl3.PCl5凝结).BCl3以气体形式进入F装置,F装置防止空气中的水蒸气进入E装置. (3)注意:Cl元素也是杂质. (4) 5Fe - 5Fe2+ - MnO4- = 解得w(Fe) = 0.0448. 版权所有:() 版权所有:()
网址:http://m.1010jiajiao.com/timu3_id_59808[举报]
下列两个反应均为在溶液中进行的反应,试按下列要求作答:
①用双线桥标明下列反应中电子的转移及数目;
②在表格中填出反应式中的氧化剂、还原剂,氧化产物、还原产物.
③将其改写成离子方程式;
(1)2FeCl3+H2S═2FeCl2+S↓+2HCl
离子方程式为:
(2)MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑
离子方程式为:
查看习题详情和答案>>
①用双线桥标明下列反应中电子的转移及数目;
②在表格中填出反应式中的氧化剂、还原剂,氧化产物、还原产物.
③将其改写成离子方程式;
(1)2FeCl3+H2S═2FeCl2+S↓+2HCl
| 氧化剂: | 还原剂: | ||
| 氧化产物: | 还原产物: |
2Fe3++H2S=2Fe2++S↓+2H+
2Fe3++H2S=2Fe2++S↓+2H+
.(2)MnO2+4HCl(浓)
| ||
| 氧化剂: | 还原剂: | ||
| 氧化产物: | 还原产物: |
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
.
| ||
现用MnO2与浓盐酸反应制氯气,再用铜粉和氯气制取少量CuCl2,其实验流程示意图如下:
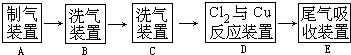
上图中“→”表示气流方向.请完成下列填空.
(1)A 中发生反应的离子方程式为
(2)B中选用的试剂是
(3)D装置中的现象为
(4)若E中的试剂选择KOH溶液,写出相应的吸收反应的化学方程式
查看习题详情和答案>>
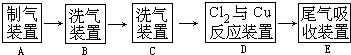
上图中“→”表示气流方向.请完成下列填空.
(1)A 中发生反应的离子方程式为
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
;
| ||
(2)B中选用的试剂是
饱和食盐水
饱和食盐水
;(3)D装置中的现象为
剧烈燃烧,产生棕黄色烟
剧烈燃烧,产生棕黄色烟
;(4)若E中的试剂选择KOH溶液,写出相应的吸收反应的化学方程式
Cl2+2KOH=KCl+KClO+H2O
Cl2+2KOH=KCl+KClO+H2O
.在实验室制取纯净的无水氯化铁很难,例如用氯化铁溶液蒸干基本上得不到无水氯化铁,但采用下列仪器和药品却可以制取较纯的无水氯化铁.
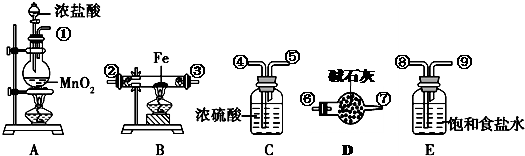
(1)直接将氯化铁溶液蒸干、灼烧得到的固体并不是无水氯化铁,而主要是
(2)如用如图所给的仪器和药品来制取较纯的无水氯化铁,请选用必要的仪器和药品组装一套装置,按从左到右的顺序写出各仪器接口的序号
(3)实验时应先点燃A与B
(4)B硬质玻璃管内右端棉花的作用是
查看习题详情和答案>>

(1)直接将氯化铁溶液蒸干、灼烧得到的固体并不是无水氯化铁,而主要是
Fe2O3
Fe2O3
.(2)如用如图所给的仪器和药品来制取较纯的无水氯化铁,请选用必要的仪器和药品组装一套装置,按从左到右的顺序写出各仪器接口的序号
①⑧⑨④⑤②③⑥
①⑧⑨④⑤②③⑥
.(3)实验时应先点燃A与B
A
A
处的酒精灯,理由是因为要先产生氯气使装置内充满氯气,以赶走装置内的空气,防止铁与空气在加热时生成铁的氧化物杂质
因为要先产生氯气使装置内充满氯气,以赶走装置内的空气,防止铁与空气在加热时生成铁的氧化物杂质
.实验开始后,A中烧瓶里观察到的现象是产生大量气泡,烧瓶内产生黄绿色气体
产生大量气泡,烧瓶内产生黄绿色气体
;反应的离子方程式为MnO2+4H++2Cl-(浓)
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-(浓)
Mn2++Cl2↑+2H2O
.
| ||
(4)B硬质玻璃管内右端棉花的作用是
防止生成的氯化铁进入导管而引起堵塞
防止生成的氯化铁进入导管而引起堵塞
;D中碱石灰有两个作用,它们是吸收多余的氯气以防止氯气污染空气;
防止空气中的水蒸气进入B使氯化铁水解
防止空气中的水蒸气进入B使氯化铁水解
吸收多余的氯气以防止氯气污染空气;
防止空气中的水蒸气进入B使氯化铁水解
.防止空气中的水蒸气进入B使氯化铁水解
(2013?德州模拟)黄铜矿的主要成分是CuFeS2(硫元素一2价,铁元素+2价).是工业炼铜的主要原料.已知黄铜矿在空气中焙烧生成cu、FeS和S02,FeS+2Hcl=FeCl+H2S.H2S是一种剧毒气体.某科研小组设计以黄铜矿为原料涮取单质铜和氯化铁晶体(FeCl3?6H2O)的流程如下:
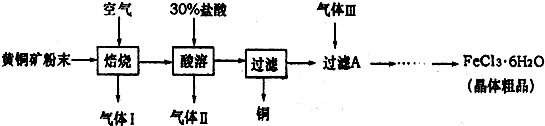
(1)92gCuFeS2在空气中焙烧生成Cu、FeS和S02转移电子的物质的量为
(2)请简述检验气体Ⅰ的操作步骤.
(3)在实验室中,欲用38%(密度为1.18g.mL-1)的盐酸配制30%的盐酸,需要的玻璃仪器主要有
(4)气体Ⅲ最好选用
A.02 B.H2 C.Cl2 D.N2
欲选用下列仪器在实验室中制取纯净干燥的该气体.

装置A中发生反应的离子方程式为
选用合适装置导管口的连接顺序为a接
查看习题详情和答案>>

(1)92gCuFeS2在空气中焙烧生成Cu、FeS和S02转移电子的物质的量为
3mol
3mol
.(2)请简述检验气体Ⅰ的操作步骤.
(3)在实验室中,欲用38%(密度为1.18g.mL-1)的盐酸配制30%的盐酸,需要的玻璃仪器主要有
量筒、玻璃棒、烧杯
量筒、玻璃棒、烧杯
.(4)气体Ⅲ最好选用
C
C
(填写序号),其主要作用是将Fe2+氧化为Fe3+,
将Fe2+氧化为Fe3+,
;A.02 B.H2 C.Cl2 D.N2
欲选用下列仪器在实验室中制取纯净干燥的该气体.

装置A中发生反应的离子方程式为
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
.
| ||
选用合适装置导管口的连接顺序为a接
ghefb
ghefb
.图中仪器G的名称是反应漏斗
反应漏斗
;在使用该仪器时,应首先检查是否漏水
检查是否漏水
.