题目内容
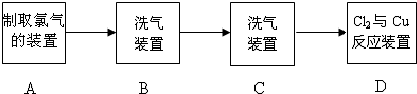
现用MnO2与浓盐酸反应制氯气,再用铜粉和氯气制取少量CuCl2,其实验流程示意图如下:
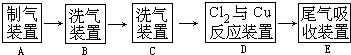
上图中“→”表示气流方向.请完成下列填空.
(1)A 中发生反应的离子方程式为
(2)B中选用的试剂是
(3)D装置中的现象为
(4)若E中的试剂选择KOH溶液,写出相应的吸收反应的化学方程式
上图中“→”表示气流方向.请完成下列填空.
(1)A 中发生反应的离子方程式为
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
;
| ||
(2)B中选用的试剂是
饱和食盐水
饱和食盐水
;(3)D装置中的现象为
剧烈燃烧,产生棕黄色烟
剧烈燃烧,产生棕黄色烟
;(4)若E中的试剂选择KOH溶液,写出相应的吸收反应的化学方程式
Cl2+2KOH=KCl+KClO+H2O
Cl2+2KOH=KCl+KClO+H2O
.分析:(1)根据浓盐酸和二氧化锰的性质判断生成物,从而写出离子反应方程式;
(2)根据混合气体的成分及氯气、氯化氢的性质分析;
(3)根据产物判断;
(4)先判断生成物,再根据离子方程式的书写规则书写.
(2)根据混合气体的成分及氯气、氯化氢的性质分析;
(3)根据产物判断;
(4)先判断生成物,再根据离子方程式的书写规则书写.
解答:解:(1)浓盐酸有还原性,二氧化锰有氧化性,浓盐酸和二氧化锰能发生氧化还原反应生成氯化锰、氯气和水.
二氧化锰是氧化物,氯气是单质,水是弱电解质,所以二氧化锰、氯气、水写化学式;HCl、MnCl2是可溶性强电解质写离子.
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
(2)浓盐酸有挥发性,浓盐酸中的水在加热条件下变成水蒸气,所以氯气中混有氯化氢和水蒸气;氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,所以可用饱和的食盐水除去HCl气体.
故答案为:饱和食盐水;
(3)氯气和铜反应生成氯化铜,氯化铜是固体,产生棕黄色烟,故答案为:剧烈燃烧,产生棕黄色烟;
(4)氯气有毒,污染环境,所以不能直接排空;氯气能和氢氧化钾反应生成氯化钾、次氯酸钾和水,所以可用氢氧化钾溶液吸收多余的氯气.氯气是单质,水是弱电解质,所以氯气、水写化学式;氢氧化钾、氯化钾、次氯酸钾是可溶性强电解质写离子.
故答案为:Cl2+2KOH=KCl+KClO+H2O.
二氧化锰是氧化物,氯气是单质,水是弱电解质,所以二氧化锰、氯气、水写化学式;HCl、MnCl2是可溶性强电解质写离子.
故答案为:MnO2+4H++2Cl-
| ||
(2)浓盐酸有挥发性,浓盐酸中的水在加热条件下变成水蒸气,所以氯气中混有氯化氢和水蒸气;氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,所以可用饱和的食盐水除去HCl气体.
故答案为:饱和食盐水;
(3)氯气和铜反应生成氯化铜,氯化铜是固体,产生棕黄色烟,故答案为:剧烈燃烧,产生棕黄色烟;
(4)氯气有毒,污染环境,所以不能直接排空;氯气能和氢氧化钾反应生成氯化钾、次氯酸钾和水,所以可用氢氧化钾溶液吸收多余的氯气.氯气是单质,水是弱电解质,所以氯气、水写化学式;氢氧化钾、氯化钾、次氯酸钾是可溶性强电解质写离子.
故答案为:Cl2+2KOH=KCl+KClO+H2O.
点评:注意以下几点:
1、氯气有强氧化性,能把变价金属离子氧化成最高价;
2、浓盐酸和二氧化锰能反应,但稀盐酸和二氧化锰不反应;
3、次氯酸是弱酸,但次氯酸具有强氧化性.
1、氯气有强氧化性,能把变价金属离子氧化成最高价;
2、浓盐酸和二氧化锰能反应,但稀盐酸和二氧化锰不反应;
3、次氯酸是弱酸,但次氯酸具有强氧化性.

练习册系列答案
相关题目