网址:http://m.1010jiajiao.com/timu3_id_59525[举报]
(8分)【化学-物质结构与性质】
利用有关知识回答下列问题:
(1)B、F两元素形成的化合物的空间构型为 ,其中心原子的杂化类型为 。
(2)CH4与 (写微粒符号)互为等电子体。
(3)写出元素Cu基态原子的电子排布式 。
(4)Fe与CO可形成的Fe(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于 晶体(填晶体类型)。
(5)Zn的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为 。
(6)金属Fe的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为 。
查看习题详情和答案>>
(8分)【化学-物质结构与性质】
利用有关知识回答下列问题:
(1)B、F两元素形成的化合物的空间构型为 ,其中心原子的杂化类型为 。
(2)CH4与 (写微粒符号)互为等电子体。
(3)写出元素Cu基态原子的电子排布式 。
(4)Fe与CO可形成的Fe(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于 晶体(填晶体类型)。
(5)Zn的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为 。
(6)金属Fe的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为 。
(8分)【化学-物质结构与性质】
利用有关知识回答下列问题:
(1)B、F两元素形成的化合物的空间构型为 ,其中心原子的杂化类型为 。
(2)CH4与 (写微粒符号)互为等电子体。
(3)写出元素Cu基态原子的电子排布式 。
(4)Fe与CO可形成的Fe(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于 晶体(填晶体类型)。
(5)Zn的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为 。
(6)金属Fe的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为 。

查看习题详情和答案>>
元素周期律是20世纪科学技术发展的重要理论依据之一.已知A、B、C、D、E五种元素都是元素周期表中前20号元素.A、B、C、D四种元素在元素周期表(长式)中的相对位置如下图所示,B、C、D的最高价氧化物的水化物两两混合,均能发生反应生成盐和水.E元素的原子序数均大于A、B、C、D元素,且不与A、B、C、D元素位于同主族.
| … | A | |||||
| B | C | D |
(1)上述A、B、C、D四种元素中第一电离能最小的是
(2)A和D的氢化物中,沸点较高的是
(3)A和E可组成离子化合物,其晶胞(在晶体中具有代表性的最小重复单元)结构如下图所示:
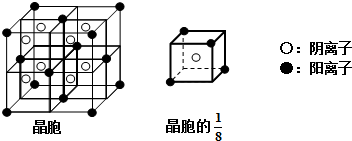
阳离子位于该正方体的顶点或面心;阴离子均位于小正方体中心.该化合物化学式为
(1)元素的第一电离能:Al
(2)基态Mn2+的核外电子排布式为
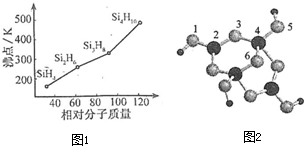
(3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图1所示,呈现这种变化关系的原因是
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、0、H 三种元素)的球棍模型如图2所示:
①在Xm-中,硼原子轨道的杂化类型有
②硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有(填序号)
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键.