题目内容
(2012?福建)[化学一物质结构与性质]

(1)元素的第一电离能:Al
(2)基态Mn2+的核外电子排布式为
(3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图1所示,呈现这种变化关系的原因是
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、0、H 三种元素)的球棍模型如图2所示:
①在Xm-中,硼原子轨道的杂化类型有
②硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有(填序号)
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键.

(1)元素的第一电离能:Al
<
<
Si(填“>”或“<“).(2)基态Mn2+的核外电子排布式为
[Ar]3d5
[Ar]3d5
.(3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图1所示,呈现这种变化关系的原因是
硅烷是分子晶体,相对分子质量越大,沸点越高
硅烷是分子晶体,相对分子质量越大,沸点越高
.(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、0、H 三种元素)的球棍模型如图2所示:
①在Xm-中,硼原子轨道的杂化类型有
SP2杂化、SP3杂化
SP2杂化、SP3杂化
;配位键存在于4号与5号
4号与5号
原子之间(填原子的数字标号); m=2
2
(填数字).②硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有(填序号)
ADE
ADE
.A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键.
分析:(1)同周期从左到右第一电离能逐渐增大趋势,ⅡA和ⅤA族则反常;
(2)根据Mn的核外电子排布式判断基态Mn2+的核外电子排布式;
(3)硅烷是分子晶体,结构相似,相对分子质量越大,分子间的范德华力越大,沸点越高;
(4)①1,3,5,6代表氧原子,2,4代表B原子,2号B形成3个键,则B原子为SP2杂化,4号B形成4个键,则B原子为SP3杂化; B一般是形成3个键,4号B形成4个键,其中1个键很可能就是配位键,配位键存在4号与5号之间,结合化合价代数和为0的原则判断;
②注意题目要求,钠离子与Xm-形成离子键,结晶水分子间存在氢键和范德华力.
(2)根据Mn的核外电子排布式判断基态Mn2+的核外电子排布式;
(3)硅烷是分子晶体,结构相似,相对分子质量越大,分子间的范德华力越大,沸点越高;
(4)①1,3,5,6代表氧原子,2,4代表B原子,2号B形成3个键,则B原子为SP2杂化,4号B形成4个键,则B原子为SP3杂化; B一般是形成3个键,4号B形成4个键,其中1个键很可能就是配位键,配位键存在4号与5号之间,结合化合价代数和为0的原则判断;
②注意题目要求,钠离子与Xm-形成离子键,结晶水分子间存在氢键和范德华力.
解答:解:(1)同周期从左到右第一电离能逐渐增大趋势,ⅡA和ⅤA族则反常,所以铝的第一电离能小硅,故答案为:;
(2)Mn的电子排布式为[Ar]3d54s2,则基态Mn2+的核外电子排布式为[Ar]3d5,故答案为:[Ar]3d5;
(3)硅烷是分子晶体,结构相似,相对分子质量越大,分子间的范德华力越大,沸点越高,
故答案为:硅烷是分子晶体,相对分子质量越大,沸点越高;
(4)①1,3,5,6代表氧原子,2,4代表B原子,2号B形成3个键,则B原子为SP2杂化,4号B形成4个键,则B原子为SP3杂化; B一般是形成3个键,4号B形成4个键,其中1个键很可能就是配位键,配位键存在4号与5号之间.观察模型,可知Xm-是(H4B4O9)m-,依据化合价H为+1,B为+3,O为-2,可得m=2,
故答案为:SP2杂化、SP3杂化;4号与5号;2;
②钠离子与Xm-形成离子键,结晶水分子间存在氢键和范德华力,故答案为:ADE.
(2)Mn的电子排布式为[Ar]3d54s2,则基态Mn2+的核外电子排布式为[Ar]3d5,故答案为:[Ar]3d5;
(3)硅烷是分子晶体,结构相似,相对分子质量越大,分子间的范德华力越大,沸点越高,
故答案为:硅烷是分子晶体,相对分子质量越大,沸点越高;
(4)①1,3,5,6代表氧原子,2,4代表B原子,2号B形成3个键,则B原子为SP2杂化,4号B形成4个键,则B原子为SP3杂化; B一般是形成3个键,4号B形成4个键,其中1个键很可能就是配位键,配位键存在4号与5号之间.观察模型,可知Xm-是(H4B4O9)m-,依据化合价H为+1,B为+3,O为-2,可得m=2,
故答案为:SP2杂化、SP3杂化;4号与5号;2;
②钠离子与Xm-形成离子键,结晶水分子间存在氢键和范德华力,故答案为:ADE.
点评:本题考查较为综合,题目难度中等,注意一般题目是比较镁铝的电离能,这样设问可见出题求异,主要考查思维能力,空间能力要求比较高,(4)中注意仔细读题,题目是问钠离子、Xm-、水分子之间的作用力,而不是硼砂晶体中的作用力,可能会多选B.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2012?福建)实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图1所示).
(2012?福建)实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图1所示).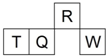 (2012?福建)短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中 T 所处的周期序数与族序数相等.下列判断不正确的是( )
(2012?福建)短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中 T 所处的周期序数与族序数相等.下列判断不正确的是( )