摘要:8.下表是元素周期表的一部分.有关说法正确的是 ( ) IA IIA IIIA IVA VA VIA VIIA 2 c d 3 a b e f A.e的氢化物比d的氢化物稳定 B.a.b.e三种元素的原子半径:e>b>a C.六种元素中.c元素单质的化学性质最活泼 D.c.e.f的最高价氧化物对应的水化物的酸性依次增强
网址:http://m.1010jiajiao.com/timu3_id_59478[举报]
[物质结构与性质]下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
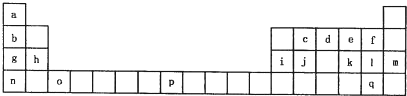
试回答下列问题:
(1)请写出元素o的基态原子电子排布式 .
(2)d的氢化物中心原子的杂化方式是 .
(3)c、e、k三种元素的电负性数值由小到大的顺序为 (用元素符号作答).
(4)f、l、q的氢化物中沸点最高的是 (写化学式)
(5)j原子形成的晶体与j原子跟c原子以1:1相互交替结合而形成的jc晶体类型相同.则j晶体的熔点 jc晶体的熔点(填“大于”“等于”“小于”)原因是: .
查看习题详情和答案>>

试回答下列问题:
(1)请写出元素o的基态原子电子排布式
(2)d的氢化物中心原子的杂化方式是
(3)c、e、k三种元素的电负性数值由小到大的顺序为
(4)f、l、q的氢化物中沸点最高的是
(5)j原子形成的晶体与j原子跟c原子以1:1相互交替结合而形成的jc晶体类型相同.则j晶体的熔点
(2011?兖州市三模)下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
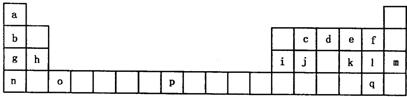
试回答下列问题:
(1)请写出元素o的基态原子电子排布式
(2)d的氢化物中心原子的杂化方式是
(3)o元素所在族的符号是
(4)d的氢化物与l的氢化物反应后的产物中包含的化学键是
(5)f、l、q的氢化物中沸点最高的是
(6)j原子形成的晶体与j原子跟c原子以1:1相互交替结合而形成的jc晶体类型相同.则j晶体的熔点
查看习题详情和答案>>

试回答下列问题:
(1)请写出元素o的基态原子电子排布式
1s22s22p63s23p63d14s2
1s22s22p63s23p63d14s2
,g元素的价电子的四个量子数依次是3,0,0,+
(或-
)
| 1 |
| 2 |
| 1 |
| 2 |
3,0,0,+
(或-
)
.| 1 |
| 2 |
| 1 |
| 2 |
(2)d的氢化物中心原子的杂化方式是
sp3
sp3
.(3)o元素所在族的符号是
ⅢB
ⅢB
.(4)d的氢化物与l的氢化物反应后的产物中包含的化学键是
离子键,共价键,配位键
离子键,共价键,配位键
.(5)f、l、q的氢化物中沸点最高的是
HF
HF
.(写化学式)(6)j原子形成的晶体与j原子跟c原子以1:1相互交替结合而形成的jc晶体类型相同.则j晶体的熔点
小于
小于
jc晶体的熔点(填“大于”“等于”“小于”)原因是因SiC晶体与晶体Si都是原子晶体,SiC中C-Si键的键长比晶体Si中Si-Si键长短,所以其键能大,因而熔沸点高
因SiC晶体与晶体Si都是原子晶体,SiC中C-Si键的键长比晶体Si中Si-Si键长短,所以其键能大,因而熔沸点高
.下表是元素周期表的一部分,针对表中的①~⑨种元素,用适当的化学用语填写下列空白:
(1)表中最活泼的金属元素是:
(2)可用于半导体材料的元素是:
第
(3)画出元素⑦的原子结构示意图:
 ,该元素与元素⑨组成的化合物的电子式是:
,该元素与元素⑨组成的化合物的电子式是:
 .
.
(4)在第3周期元素的最高价氧化物对应水化物中,酸性最强的是:
查看习题详情和答案>>
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
K
K
.(填元素符号)(2)可用于半导体材料的元素是:
Si
Si
(填元素符号),它在元素周期表中的位置为第
3
3
周期ⅣA
ⅣA
族.(3)画出元素⑦的原子结构示意图:




(4)在第3周期元素的最高价氧化物对应水化物中,酸性最强的是:
HClO4
HClO4
(填化学式,下同);碱性最强的是:NaOH
NaOH
;具有两性的是Al(OH)3
Al(OH)3
,其与氢氧化钠溶液反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O
Al(OH)3+OH-═AlO2-+2H2O
.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是: (填具体化学用语,下同).
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是 ,碱性最强的化合物的电子式是: .
(3)最高价氧化物是两性氧化物的元素是 ;写出它的氧化物与氢氧化钠反应的离子方程式 .
(4)②氢化物与的③单质一定条件下反应的化学方程式 .
(5)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因
(6)用结构式表示元素①与③形成的化合物 ,该化合物在固体时俗称 ,属于 晶体,指出它的一种用途 .
(7)写出④的单质与水反应的化学方程式 .
查看习题详情和答案>>
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是
(3)最高价氧化物是两性氧化物的元素是
(4)②氢化物与的③单质一定条件下反应的化学方程式
(5)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因
(6)用结构式表示元素①与③形成的化合物
(7)写出④的单质与水反应的化学方程式
下表是元素周期表的一部分,有关说法正确的是( )
②h、i两种元素阴离子的还原性:h>i ③a、g两种元素氢化物的稳定性:a>g ④d、e、f三种元素最高价氧化物对应的水化物的碱性依次增强 ⑤八种元素中d元素的单质还原性最强,i元素的单质氧化性最强. |
查看习题详情和答案>>