网址:http://m.1010jiajiao.com/timu3_id_59281[举报]
(2011·吉林省实验中学模考)在一定温度下,向一个容积可变的容器中,通入3mol SO2和2 mol O2及固体催化剂,使之发生反应:2SO2(g)+O2(g) 2SO3(g);ΔH=-196.6 kJ·mol-1,平衡时容器内气体压强为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4mol SO2、3 mol O2、2 mol SO3(g),下列说法正确的是( )
A.第一次平衡时反应放出的热量为294.9 kJ
B.两次平衡SO2的转化率相等
C.第二次达平衡时SO3的体积分数大于
D.达平衡时用O2表示的反应速率为0.25mol·L-1·min-1
查看习题详情和答案>>
 (09江苏卷)下列有关实验操作的叙述正确的是:
(09江苏卷)下列有关实验操作的叙述正确的是:
A.实验室常用右图所示的装置制取少量的乙酸乙酯
B.用50mL酸式滴定管可准确量取25.00mLKMnO4 溶液
C.用量筒量取5.00mL1.00mol·L-1 盐酸于50mL容量瓶中,
加水稀释至刻度,可配制0.100mol·L-1 盐酸
D.用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出
查看习题详情和答案>>(2011·吉林省实验中学模考)在一定温度下,向一个容积可变的容器中,通入3
mol SO2和2 mol O2及固体催化剂,使之发生反应:2SO2(g)+O2(g)  2SO3(g);ΔH=-196.6 kJ·mol-1,平衡时容器内气体压强为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4
mol SO2、3 mol O2、2 mol SO3(g),下列说法正确的是( )
2SO3(g);ΔH=-196.6 kJ·mol-1,平衡时容器内气体压强为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4
mol SO2、3 mol O2、2 mol SO3(g),下列说法正确的是( )
A.第一次平衡时反应放出的热量为294.9 kJ
B.两次平衡SO2的转化率相等
C.第二次达平衡时SO3的体积分数大于
D.达平衡时用O2表示的反应速率为0.25 mol·L-1·min-1
查看习题详情和答案>>
(09江苏高考化学)下列化学实验事实及其解释都正确的是:
A.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
B.向SO2 水溶液中滴加盐酸酸化的BaCl2 溶液,有白色沉淀生成,说明BaSO4 难溶于盐酸
C.向0.1mol·L-1 FeSO4 溶液中滴加少量酸性KMnO4 溶液,KMnO4 溶液褪色,说明Fe2+具有氧化性
D.向2.0mL浓度均为0.1mol·L-1 的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1 AgNO3 溶液, 振荡,沉淀呈黄色,说明AgCl 的Ksp比AgI 的Ksp大
查看习题详情和答案>>(09江苏高考化学)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
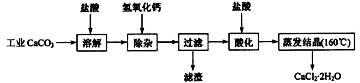 |
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量 Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是 。
(2)酸化操作是加入盐酸,调节溶液的pH为4.0,其目的有:①将溶液中的少量 Ca(OH)2 转化为CaCl2;②防止Ca2+在蒸发时水解;③ 。
(3)测定样品中Cl-含量的方法是:a.称取0.7500g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测液于锥形瓶中;c.用0.05000mol·L-1 AgNO3 溶液滴定至终点,消耗AgNO3 溶液体积的平均值为20.39mL。①上述测定过程中需用溶液润洗的仪器有: 。②计算上述样品中CaCl2·2H2O的质量分数为: 。③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有: ; 。
查看习题详情和答案>>