网址:http://m.1010jiajiao.com/timu3_id_58735[举报]
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量 | 25±15mg/kg |
| 储存方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
A.高温会导致碘的损失
B.碘酸钾可氧化氯化钠
C.只用淀粉就能检验碘盐中的碘酸钾
D.该碘盐中碘酸钾含量为20~50mg/kg
(2)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式,并用单线标出电子转移的方向和数目.
该反应的氧化剂为
(3)已知:I2+2S2O
2- 3 |
2- 6 |
a.准确称取w g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol?L-1的Na2S2O3溶液10.0mL,恰好反应完全.
则所测盐中碘的含量是(以含w的代数式表示)
| 4.2×102 |
| w |
| 4.2×102 |
| w |
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2?3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.现利用图所示装置进行实验.
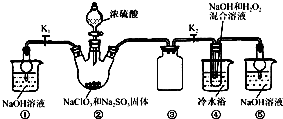
(1)装置③的作用是
(2)装置②中产生ClO2的化学方程式为
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③
实验Ⅱ:测定某亚氯酸钠样品的纯度.
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:Cl
| O | - 2 |
②移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol?L-1 Na2S2O3标准液滴定,至滴定终点.重复2次,测得平均值为V mL(已知:I2+2S2
| O | - 2 |
| O | 2- 6 |
(4)达到滴定终点时的现象为
(5)该样品中NaClO2的质量分数为
| 90.5cV |
| 4m |
| 90.5cV |
| 4m |
(6)在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为
(11分)已知:I2+2 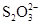 ===
=== 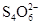 +2I-。相关物质的溶度积常数见下表:
+2I-。相关物质的溶度积常数见下表:
|
物质 |
Cu(OH)2 |
Fe(OH)3 |
CuCl |
CuI |
|
Ksp |
2.2×10-20 |
2.6×10-39 |
1.7×10-7 |
1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是__________________________(用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是__________________________________________________。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用________作滴定指示剂,滴定终点的现象是________________________。
②CuCl2溶液与KI反应的离子方程式为___________________________。
③该试样中CuCl2·2H2O的质量百分数为________。
查看习题详情和答案>>
(11分)已知:I2+2 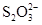 ===
=== 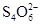 +2I-。相关物质的溶度积常数见下表:
+2I-。相关物质的溶度积常数见下表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是__________________________(用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是__________________________________________________。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用________作滴定指示剂,滴定终点的现象是________________________。
②CuCl2溶液与KI反应的离子方程式为___________________________。
③该试样中CuCl2·2H2O的质量百分数为________。 查看习题详情和答案>>
]已知:I2+2![]() =
=![]() +2I-。相关物质的溶度积常数见下表:
+2I-。相关物质的溶度积常数见下表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2•2H2O晶体,加入________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_____________。
过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体。
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,原因是___________________(用化学方程式表示)。由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是___________。
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I―发生反应的氧化性质杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用___________作滴定指示剂,滴定终点的现象是_________________。
②CuCl2溶液与KI反应的离子方程式为______________________________。
③该试样中CuCl2•2H2O的质量百分数为___________________________。
查看习题详情和答案>>