题目内容
(2012?信阳一模)下表是某食用碘盐包装袋上的部分说明:
(1)下列说法正确的是
A.高温会导致碘的损失
B.碘酸钾可氧化氯化钠
C.只用淀粉就能检验碘盐中的碘酸钾
D.该碘盐中碘酸钾含量为20~50mg/kg
(2)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式,并用单线标出电子转移的方向和数目.
该反应的氧化剂为
(3)已知:I2+2S2O
═2I-+4SO
.某学生测定食用碘盐中碘的含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol?L-1的Na2S2O3溶液10.0mL,恰好反应完全.
则所测盐中碘的含量是(以含w的代数式表示)
mg/kg.
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量 | 25±15mg/kg |
| 储存方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
A
A
.A.高温会导致碘的损失
B.碘酸钾可氧化氯化钠
C.只用淀粉就能检验碘盐中的碘酸钾
D.该碘盐中碘酸钾含量为20~50mg/kg
(2)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式,并用单线标出电子转移的方向和数目.
1
1
KIO3+5
5
KI+3
3
H2SO4═3
3
K2SO4+3
3
I2+3
3
H2O该反应的氧化剂为
KIO3
KIO3
.(3)已知:I2+2S2O
2- 3 |
2- 6 |
a.准确称取w g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol?L-1的Na2S2O3溶液10.0mL,恰好反应完全.
则所测盐中碘的含量是(以含w的代数式表示)
| 4.2×102 |
| w |
| 4.2×102 |
| w |
分析:(1)A.高温时碘酸钾易分解;
B.碘酸钾和氯化钠不反应;
C.淀粉试液能检验碘单质;
D.根据碘和碘酸钾的关系式计算碘酸钾的质量;
(2)根据氧化还原反应中得失电子数相等配平,含元素化合价降低的物质为氧化剂;
(3)根据KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O、I2+2S2O32-═2I-+4SO62-可知,存在KIO3~3I2~6S2O32-,以此计算.
B.碘酸钾和氯化钠不反应;
C.淀粉试液能检验碘单质;
D.根据碘和碘酸钾的关系式计算碘酸钾的质量;
(2)根据氧化还原反应中得失电子数相等配平,含元素化合价降低的物质为氧化剂;
(3)根据KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O、I2+2S2O32-═2I-+4SO62-可知,存在KIO3~3I2~6S2O32-,以此计算.
解答:解:A.根据说明知,高温时碘酸钾易分解,否则会导致碘的损失,故A正确;
B.如果碘酸钾和氯化钠反应,则食盐中就不存在碘酸钾,实际上碘酸钾和氯化钠不反应,故B错误;
C.碘遇淀粉试液变蓝色,所以淀粉试液能检验碘单质,食盐中含有碘酸钾而不是碘单质,淀粉试液和碘不反应,所以不能用淀粉检验碘盐中的碘酸钾,故C错误;
D.根据KIO3~I知,
mg=33.7mg<碘酸钾的质量<
mg=84.25mg,故D错误;
故答案为:A;
(2)该反应中化合价的变化为:KIO3→I2,I元素由+5价→0价,一个KIO3分子得5个电子;KI→I2,I元素由-1价→0价,一个KI分子失一个电子,所以得失电子的最小公倍数为5,KIO3的计量数为1,KI的计量数为5,其它元素根据原子守恒配平,转移电子方向和数目为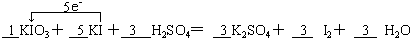 ,KIO3中I元素的化合价降低,则KIO3为氧化剂,
,KIO3中I元素的化合价降低,则KIO3为氧化剂,
故答案为: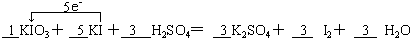 ;KIO3;
;KIO3;
(3)根据KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O、I2+2S2O32-═2I-+4SO62-可知,存在KIO3~3I2~6S2O32-,则
I~KIO3~3I2~6S2O32-,
127 6
x 0.01L×2.0×10-3mol?L-1,
=
,
解得x=42.3×10-5g,
则w g食盐中含I元素的质量为42.3×10-5g,所以盐中碘的含量是
=
mg/kg,
故答案为:
.
B.如果碘酸钾和氯化钠反应,则食盐中就不存在碘酸钾,实际上碘酸钾和氯化钠不反应,故B错误;
C.碘遇淀粉试液变蓝色,所以淀粉试液能检验碘单质,食盐中含有碘酸钾而不是碘单质,淀粉试液和碘不反应,所以不能用淀粉检验碘盐中的碘酸钾,故C错误;
D.根据KIO3~I知,
| 20 |
| 127 |
| 50×214 |
| 127 |
故答案为:A;
(2)该反应中化合价的变化为:KIO3→I2,I元素由+5价→0价,一个KIO3分子得5个电子;KI→I2,I元素由-1价→0价,一个KI分子失一个电子,所以得失电子的最小公倍数为5,KIO3的计量数为1,KI的计量数为5,其它元素根据原子守恒配平,转移电子方向和数目为
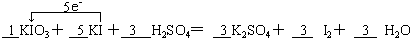 ,KIO3中I元素的化合价降低,则KIO3为氧化剂,
,KIO3中I元素的化合价降低,则KIO3为氧化剂,故答案为:
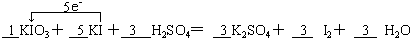 ;KIO3;
;KIO3;(3)根据KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O、I2+2S2O32-═2I-+4SO62-可知,存在KIO3~3I2~6S2O32-,则
I~KIO3~3I2~6S2O32-,
127 6
x 0.01L×2.0×10-3mol?L-1,
| 127 |
| x |
| 6 |
| 0.01L×0.002mol/L |
解得x=42.3×10-5g,
则w g食盐中含I元素的质量为42.3×10-5g,所以盐中碘的含量是
| 42.3×10-5×1000mg |
| w×10-3kg |
| 4.2×102 |
| w |
故答案为:
| 4.2×102 |
| w |
点评:本题以碘及其化合物考查了氧化还原反应方程式的配平及有关计算,计算时注意是求食盐中碘的含量不是碘酸钾的含量,题目难度中等.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目