网址:http://m.1010jiajiao.com/timu3_id_5814[举报]
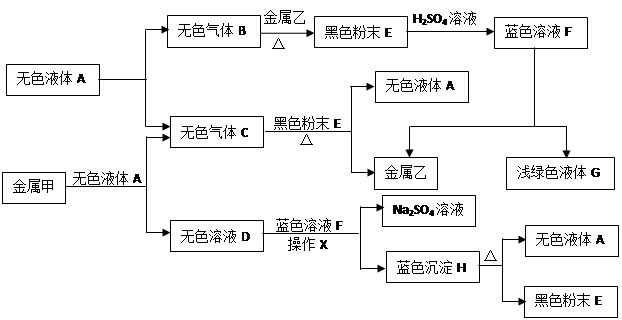
请回答下列问题:
(1)写出A、E、G的化学式:A ▲ ,E ▲ ,G ▲ 。
(2)操作X的名称是 ▲ 。
(3)①无色溶液D与蓝色溶液F反应的化学方程式为 ▲ ;
②金属甲与无色液体A反应的化学方程式为 ▲ ,该反应的基本类型 ▲ ;
③蓝色沉淀H受热分解反应的化学方程式为 ▲ 。
(4)甲、乙、丙三种金属的活动性由强到弱的顺序是 ▲ ,无色气体C在点燃或加热前必须进行的操作是 ▲ 。
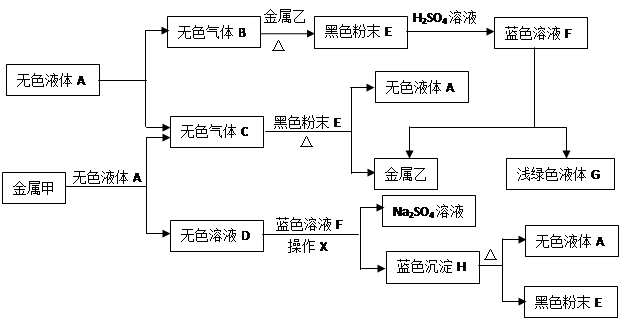
请回答下列问题:
(1)写出A、E、G的化学式:A ▲ ,E ▲ ,G ▲ 。
(2)操作X的名称是 ▲ 。
(3)①无色溶液D与蓝色溶液F反应的化学方程式为 ▲ ;
②金属甲与无色液体A反应的化学方程式为 ▲ ,该反应的基本类型 ▲ ;
③蓝色沉淀H受热分解反应的化学方程式为 ▲ 。
(4)甲、乙、丙三种金属的活动性由强到弱的顺序是 ▲ ,无色气体C在点燃或加热前必须进行的操作是 ▲ 。
⑴M元素的单质可用于原子反应堆的导热剂,
其原子结构示意图如下:
① 该原子有 个电子层,X的值是 ,
M元素属于 (填“金属”或“非金属”)元素;
② M元素的化学性质与下列 (填序号)元素的化学性质相似。

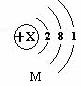
③ M元素和第②小题的D元素形成化合物的化学式是 。
(2)世界上的物质都是由粒子构成的,仿照示例填空
物质名称 | 示例:水 | 铁 | 氯化钠 | |
构成物质的粒子 | 分子 | 分子 |
某兴趣小组同学对实验室制取氧气的条件进行如下探究实验.
①为探究催化剂的种类对氯酸钾分解速度的影响,甲设计以下对比试验:
I.将3.0gKClO3与1.0gMnO2均匀混合加热
II.将xgKClO3与1.0gCuO均匀混合加热
在相同温度下,比较两组实验产生O2的快慢.
I中反应的化学方程式是 ;II中x的值为 .
②乙探究了影响双氧水分解速度的某种因素,实验数据记录如表:
| 双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2的体积 | |
| I | 50.0g | 1% | 0.1g | 9mL |
| II | 50.0g | 2% | 0.1g | 16mL |
| III | 50.0g | 4% | 0.1g | 31mL |
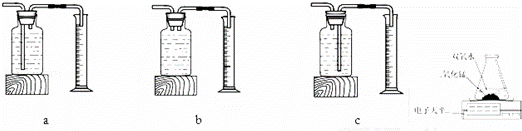
实验结论:在相同条件下, ,双氧水分解得快.
丙用如图装置进行实验,通过比较 也能达到实验目的.
查看习题详情和答案>>(10分)已知:①金属钠是一种活泼的金属,与水反应生成氧氧化钠和氢气;②难溶于水的碱受热分解生成相应的氧化物和水。A、B、C、D、E、F、G、H是初中化学中常见的物质,甲、乙、丙是三种金属。其中甲最活泼,乙是红色金属,丙能被磁铁吸引。各物质间相互转化关系如下图: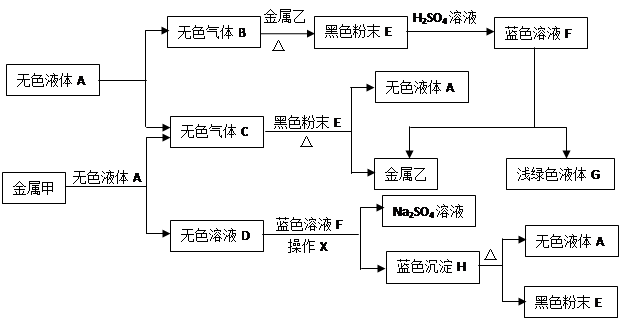
请回答下列问题:
(1)写出A、E、G的化学式:A ▲ ,E ▲ ,G ▲ 。
(2)操作X的名称是 ▲ 。
(3)①无色溶液D与蓝色溶液F反应的化学方程式为 ▲ ;
②金属甲与无色液体A反应的化学方程式为 ▲ ,该反应的基本类型 ▲ ;
③蓝色沉淀H受热分解反应的化学方程式为 ▲ 。
(4)甲、乙、丙三种金属的活动性由强到弱的顺序是 ▲ ,无色气体C在点燃或加热前必须进行的操作是 ▲ 。