题目内容
(10分)已知:①金属钠是一种活泼的金属,与水反应生成氧氧化钠和氢气;②难溶于水的碱受热分解生成相应的氧化物和水。A、B、C、D、E、F、G、H是初中化学中常见的物质,甲、乙、丙是三种金属。其中甲最活泼,乙是红色金属,丙能被磁铁吸引。各物质间相互转化关系如下图:
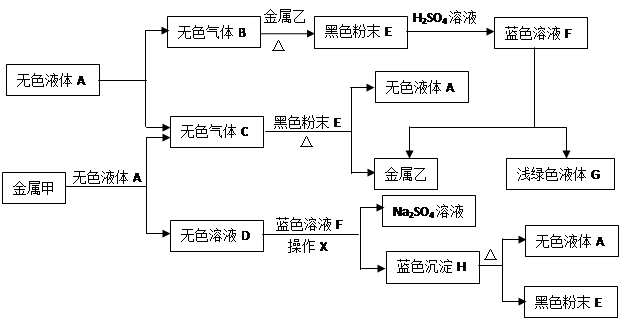
请回答下列问题:
(1)写出A、E、G的化学式:A ▲ ,E ▲ ,G ▲ 。
(2)操作X的名称是 ▲ 。
(3)①无色溶液D与蓝色溶液F反应的化学方程式为 ▲ ;
②金属甲与无色液体A反应的化学方程式为 ▲ ,该反应的基本类型 ▲ ;
③蓝色沉淀H受热分解反应的化学方程式为 ▲ 。
(4)甲、乙、丙三种金属的活动性由强到弱的顺序是 ▲ ,无色气体C在点燃或加热前必须进行的操作是 ▲ 。
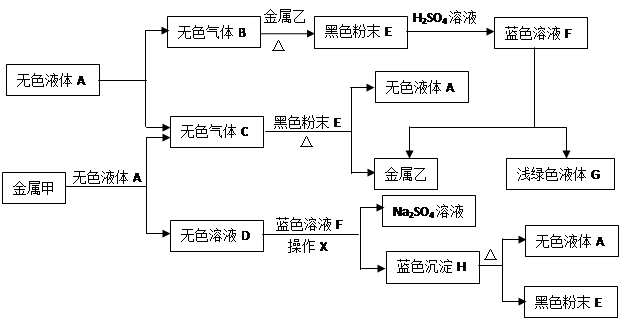
请回答下列问题:
(1)写出A、E、G的化学式:A ▲ ,E ▲ ,G ▲ 。
(2)操作X的名称是 ▲ 。
(3)①无色溶液D与蓝色溶液F反应的化学方程式为 ▲ ;
②金属甲与无色液体A反应的化学方程式为 ▲ ,该反应的基本类型 ▲ ;
③蓝色沉淀H受热分解反应的化学方程式为 ▲ 。
(4)甲、乙、丙三种金属的活动性由强到弱的顺序是 ▲ ,无色气体C在点燃或加热前必须进行的操作是 ▲ 。
(10分,每空1分)
(1) A:H2O E:CuO G:FeSO4
(2) 过滤
(3) ①2NaOH+CuSO4=Na2SO4+Cu(OH)2↓ ②2Na+2H2O=2NaOH+H2↑ 置换反应
 ③Cu(OH)2====CuO+H2O
③Cu(OH)2====CuO+H2O
(4) 甲丙乙 检验气体的纯度或验纯
(1) A:H2O E:CuO G:FeSO4
(2) 过滤
(3) ①2NaOH+CuSO4=Na2SO4+Cu(OH)2↓ ②2Na+2H2O=2NaOH+H2↑ 置换反应
 ③Cu(OH)2====CuO+H2O
③Cu(OH)2====CuO+H2O(4) 甲丙乙 检验气体的纯度或验纯
分析:乙是红色金属,丙能被磁铁吸引,说明乙是金属铜,丙是金属铁;金属甲和无色液体A反应生成无色气体C和无色溶液D,而且溶液D还能够和蓝色溶液F即硫酸铜溶液反应,因此无色溶液D为碱溶液即氢氧化钠溶液,则金属甲为钠,无色液体A为水,无色气体C为氢气,则蓝色沉淀就为氢氧化铜,由于难溶于水的碱受热分解生成相应的氧化物和水,则黑色粉末为氧化铜;由于水在通电条件可以生成氧气和氢气,则无色气体B就是氧气.
解:(1)根据一种无色液体可以分解得到两种气体,可推出A是水,进而可以顺推出E是氧化铜,而G是浅绿色溶液,且是由硫酸铜所得,因此G应为硫酸亚铁溶液,故答案为:H2O,CuO,FeSO4
(2)由于操作X把沉淀和溶液分开,因此该操作是过滤,故答案为:过滤
(3)①由于D是氢氧化钠溶液,蓝色溶液F是硫酸铜溶液,故答案为:2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
②由于甲是金属钠,无色液体A是水,而且两者发生的反应是一种单质和一种化合物反应生成了另外一种单质和一种化合物,故答案为:2Na+2H2O=2NaOH+H2↑,置换反应
③由于难溶性碱加热分解生成金属氧化物和水,故答案为:Cu(OH)2 CuO+H2O
CuO+H2O
(4)在金属活动性顺序中,越靠前的金属化学性质越活泼,因此甲(钠)、乙(铜)、丙(铁)的活动性由强到弱的顺序是甲>丙>乙;由于氢气具有可燃性,因此在点燃或加热前必须要验纯;故答案为:甲、丙、乙,验纯
点评:本题难度较大,主要考查了金属的化学性质、金属活动性顺序的应用及有关物质的性质,培养学生的分析能力、理解能力和解决问题的能力.
解:(1)根据一种无色液体可以分解得到两种气体,可推出A是水,进而可以顺推出E是氧化铜,而G是浅绿色溶液,且是由硫酸铜所得,因此G应为硫酸亚铁溶液,故答案为:H2O,CuO,FeSO4
(2)由于操作X把沉淀和溶液分开,因此该操作是过滤,故答案为:过滤
(3)①由于D是氢氧化钠溶液,蓝色溶液F是硫酸铜溶液,故答案为:2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
②由于甲是金属钠,无色液体A是水,而且两者发生的反应是一种单质和一种化合物反应生成了另外一种单质和一种化合物,故答案为:2Na+2H2O=2NaOH+H2↑,置换反应
③由于难溶性碱加热分解生成金属氧化物和水,故答案为:Cu(OH)2
 CuO+H2O
CuO+H2O(4)在金属活动性顺序中,越靠前的金属化学性质越活泼,因此甲(钠)、乙(铜)、丙(铁)的活动性由强到弱的顺序是甲>丙>乙;由于氢气具有可燃性,因此在点燃或加热前必须要验纯;故答案为:甲、丙、乙,验纯
点评:本题难度较大,主要考查了金属的化学性质、金属活动性顺序的应用及有关物质的性质,培养学生的分析能力、理解能力和解决问题的能力.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案
相关题目