摘要:第Ⅱ卷16. (1)半径从大到小的顺序是 (填元素符号或化学式.下同), 第一电离能从大到小的顺序是 (2)X的化学式为 . X受热分解的化学方程式为 . (3) Y的化学式为 . 与Y的阴离子具有相同原子数和电子数的分子有 . Y与盐酸反应的离子方程式为 .
网址:http://m.1010jiajiao.com/timu3_id_58082[举报]
下表中所列的是8种短周期元素原子的半径及主要化合价:
(1)C元素在周期表中的位置为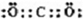
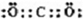 ,G元素最低价氢化物的空间构型为
,G元素最低价氢化物的空间构型为
(2)B、D、E所代表元素的离子半径从大到小的顺序为
(3)C与E形成的化合物属于
(4)周期表中有些元素存在“对角线相似”现象(一种元素的性质常同它右下方相邻的另一种元素具有类似性),请写出A的单质与强碱溶液反应的离子方程式:
(5)有人认为:H-E键的键能大于H-L键的键能,所以H2E的沸点高于H2L的沸点.你是否赞同这种观点
查看习题详情和答案>>
| 元素代号 | A | B | C | D | E | G | L | I |
| 原子半径/nm | 0.111 | 0.064 | 0.117 | 0.16 | 0.066 | 0.070 | 0.104 | 0.077 |
| 主要化合价 | +2 | -1 | +4,-4 | +2 | -2 | +5.-3 | +6,-2 | +4,-4 |
第三周期ⅣA族
第三周期ⅣA族
;IE2的电子式为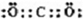
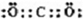
三角锥型
三角锥型
.(2)B、D、E所代表元素的离子半径从大到小的顺序为
O2->F->Mg2+
O2->F->Mg2+
(填离子符号).G、C最高价氧化物对应水化物的酸性强弱关系为(写化学式)HNO3>H2SiO3
HNO3>H2SiO3
.(3)C与E形成的化合物属于
原子
原子
晶体.(4)周期表中有些元素存在“对角线相似”现象(一种元素的性质常同它右下方相邻的另一种元素具有类似性),请写出A的单质与强碱溶液反应的离子方程式:
Be+2OH-═BeO22-+H2↑
Be+2OH-═BeO22-+H2↑
.(5)有人认为:H-E键的键能大于H-L键的键能,所以H2E的沸点高于H2L的沸点.你是否赞同这种观点
不赞同
不赞同
(填“赞同”或“不赞同”),理由:H2O与H2S所成晶体为分子晶体,H2O的熔沸点高于H2S的熔沸点与键能无关
H2O与H2S所成晶体为分子晶体,H2O的熔沸点高于H2S的熔沸点与键能无关
.粉煤灰是燃煤电厂的工业废渣,其中含莫来石(Al6Si2O13)的质量分数为38%,还有含量较多的SiO2.用粉煤灰和纯碱在高温下烧结,可制取NaAlSiO4,有关化学反应方程式:Al6Si2O13+3Na2CO3→2NaAlSiO4+4NaAlO2+3CO2↑结合上述反应完成下列填空:
(1)上述反应所涉及的元素中,原子核外电子数最多的元素在周期表中的位置是
(2)上述元素中有三种元素在元素周期表中处于相邻位置,其原子半径从大到小的顺序为:
(3)二氧化碳分子的空间构型为
(4)上述元素中有两种元素是同一主族,可以作为判断两者非金属性强弱的依据的是
a.该两种原子形成的共价键中共用电子对的偏向 b.最高价氧化物熔沸点高低
c.最高价氧化物对应水化物的酸性强弱 d.单质与酸反应的难易程度.
查看习题详情和答案>>
(1)上述反应所涉及的元素中,原子核外电子数最多的元素在周期表中的位置是
第三周期第ⅣA族
第三周期第ⅣA族
,其氧化物属于原子
原子
晶体.(2)上述元素中有三种元素在元素周期表中处于相邻位置,其原子半径从大到小的顺序为:
Al
Al
>Si
Si
>C
C
(用元素符号表示).(3)二氧化碳分子的空间构型为
直线
直线
型.(4)上述元素中有两种元素是同一主族,可以作为判断两者非金属性强弱的依据的是
ac
ac
(填编号).a.该两种原子形成的共价键中共用电子对的偏向 b.最高价氧化物熔沸点高低
c.最高价氧化物对应水化物的酸性强弱 d.单质与酸反应的难易程度.
X、Y、Z、L、M五种元素的原子序数依次增大.X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素.回答下列问题:
(1)L的元素符号为
(2)Z、X两元素按原子数目比l:3和2:4构成分子A和B,A的电子式为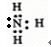
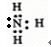 ,B的结构式为
,B的结构式为
 .
.
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为
 其最高价氧化物对应的水化物化学式为
其最高价氧化物对应的水化物化学式为
查看习题详情和答案>>
(1)L的元素符号为
O
O
;M在元素周期表中的位置为第3周期,第ⅢA族
第3周期,第ⅢA族
;五种元素的原子半径从大到小的顺序是Al>C>N>O>H
Al>C>N>O>H
(用元素符号表示).(2)Z、X两元素按原子数目比l:3和2:4构成分子A和B,A的电子式为
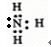
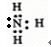


(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为
34
34
,原子结构示意图为:

H2SeO4
H2SeO4
.(2013?南开区一模)X、Y、Z、W、R是元素周期表前四周期中的常见元素,其相关信息如下表:
(1)W在元素周期表中的位置为
(2)X与氢两元素按原子数目比1:3和2:4构成分子A和B,A的结构式为
 ;B的电子式为
;B的电子式为
 .化合物ZY中存在的化学键类型为
.化合物ZY中存在的化学键类型为
(3)砷(As)是人体必需的微量元素,与X同一主族,As原子比X原子多两个电子层,则砷的原子序数为
(4)用RCl3溶液腐蚀铜线路板的离子方程式为
(5)Z-W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成.该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2═17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0mol/L HCl溶液中能完全释放出H2.1mol Zl7W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为
查看习题详情和答案>>
| 元素 | 相关信息 |
| X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Y | 地壳中含量最高的元素 |
| Z | 存在质量数为23,中子数为11的核素 |
| W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
| R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
第三周期第ⅢA族
第三周期第ⅢA族
;X、Y、Z、W四种元素的原子半径从大到小的顺序是Mg>Al>N>O
Mg>Al>N>O
(用元素符号表示).(2)X与氢两元素按原子数目比1:3和2:4构成分子A和B,A的结构式为




离子键
离子键
.(3)砷(As)是人体必需的微量元素,与X同一主族,As原子比X原子多两个电子层,则砷的原子序数为
33
33
,其最高价氧化物的化学式为As2O5
As2O5
.该族2~4周期元素的气态氢化物的稳定性从大到小的顺序是NH3>PH3>AsH3
NH3>PH3>AsH3
(用化学式表示).(4)用RCl3溶液腐蚀铜线路板的离子方程式为
2Fe3++Cu=Cu2++2Fe2+
2Fe3++Cu=Cu2++2Fe2+
.检验溶液中R3+常用的试剂是KSCN溶液
KSCN溶液
,可以观察到的现象是溶液呈红色
溶液呈红色
.(5)Z-W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成.该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2═17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0mol/L HCl溶液中能完全释放出H2.1mol Zl7W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为
52mol
52mol
. (2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.
(2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.(1)在光照条件下.氯气和氢气反应过程如下:
①Cl2→Cl+Cl ②Cl+H2→HCl+H ③H+Cl2→HCl+Cl …
反应②中形成的化合物的电子式为


非极性
非极性
键(填“极性”或“非极性”).(2)在短周期主族元素中,氯元素及与其相邻元素的原予半径从大到小的顺序是
S>Cl>F
S>Cl>F
.(用元素符号表示).与氯元素同周期且金属性最强的元素位于周期表的第
三
三
周期IA
IA
族.(3)卤索单质及化合物在许多性质上都存在着递变规律.下列有关说法正确的是
a
a
.a.卤化银的颜色按AgCl、AgBr、AgI的顺序依次加深
b?卤化氢的键长按H-F、H-Cl、H-Br、H-I的顺序依次减小
c?卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
d?卤索单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易
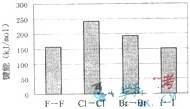
(4)卤素单质的键能大小如图.由图推断:
①非金属性强的卤素,其单质分子的化学键
不一定容易
不一定容易
断裂(填“容易”或“不容易”或“不一定容易”).②卤素单质键能大小与键长的关系为:
除F2外.键长增大,键能减小
除F2外.键长增大,键能减小
.