题目内容
 (2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.
(2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.(1)在光照条件下.氯气和氢气反应过程如下:
①Cl2→Cl+Cl ②Cl+H2→HCl+H ③H+Cl2→HCl+Cl …
反应②中形成的化合物的电子式为


非极性
非极性
键(填“极性”或“非极性”).(2)在短周期主族元素中,氯元素及与其相邻元素的原予半径从大到小的顺序是
S>Cl>F
S>Cl>F
.(用元素符号表示).与氯元素同周期且金属性最强的元素位于周期表的第
三
三
周期IA
IA
族.(3)卤索单质及化合物在许多性质上都存在着递变规律.下列有关说法正确的是
a
a
.a.卤化银的颜色按AgCl、AgBr、AgI的顺序依次加深
b?卤化氢的键长按H-F、H-Cl、H-Br、H-I的顺序依次减小
c?卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
d?卤索单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易
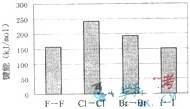
(4)卤素单质的键能大小如图.由图推断:
①非金属性强的卤素,其单质分子的化学键
不一定容易
不一定容易
断裂(填“容易”或“不容易”或“不一定容易”).②卤素单质键能大小与键长的关系为:
除F2外.键长增大,键能减小
除F2外.键长增大,键能减小
.分析:(1)HCl分子中共用一对电子,同一元素组成的双原子分子为非极性分子,不同种元素组成的分子为极性分子,氯气为非极性分子;
(2)根据同周期和同主族元素原子的半径变化规律,元素金属性的变化规律进行解答;
(3)第ⅥA族元素中,随着原子序数的增大得电子能力逐渐减弱、氢化物的酸性逐渐增强、单质的沸点逐渐增大、单质的氧化性逐渐减弱、氢化物的还原性逐渐增强、单质与氢气化合逐渐困难、氢化物的沸点逐渐增大(HF除外)、氢化物的稳定性逐渐减弱,据此解答;
(4)根据卤素单质的键能大小图解答;
(2)根据同周期和同主族元素原子的半径变化规律,元素金属性的变化规律进行解答;
(3)第ⅥA族元素中,随着原子序数的增大得电子能力逐渐减弱、氢化物的酸性逐渐增强、单质的沸点逐渐增大、单质的氧化性逐渐减弱、氢化物的还原性逐渐增强、单质与氢气化合逐渐困难、氢化物的沸点逐渐增大(HF除外)、氢化物的稳定性逐渐减弱,据此解答;
(4)根据卤素单质的键能大小图解答;
解答:解:(1)反应②中形成的化合物是氯化氢,氯化氢为共价化合物,一个氢原子核外为1个电子,1个氯原子核外最外层有7个电子,HCl分子中共用一对电子,所以电子式为 ;反应③为氢原子和氯气反应,所以破坏的是氯气分子中的氯氯键,同一元素组成的双原子分子为非极性分子,所以破坏的是非极性共价键,
;反应③为氢原子和氯气反应,所以破坏的是氯气分子中的氯氯键,同一元素组成的双原子分子为非极性分子,所以破坏的是非极性共价键,
故答案为: ;非极性;
;非极性;
(2)短周期主族元素中与氯元素相邻的有F和S,根据同周期和同主族元素原子的半径变化规律同一周期,从左到右,原子序数增大,半径在逐渐减小,所以原子半径S>Cl,同一主族,从上往下,半径在逐渐增大,所以原子半径Cl>F,综上可知,三者的原子半径从大到小的顺序是S>Cl>F;与氯同周期,金属性最强的元素位于该周期的最左侧,为Na元素,钠为第三周期,第IA,
故答案为:S>Cl>F; 三;IA;
(3)a.卤化银的颜色按AgCl为白色固体、AgBr为浅黄色固体、AgI为黄色固体,所以它们的颜色依次加深,故a正确;
b?同一主族,从上往下,半径在逐渐增大,所以原子半径I>Br>Cl>F,所以卤化氢的键长按H-F、H-Cl、H-Br、H-I的顺序依次增大,故b错误;
c?随着原子序数的增大,单质得电子能力逐渐减弱,所以其阴离子失电子能力逐渐增强,所以HF、HCl、HBr、HI的还原性按HF、HCl、HBr、HI的顺序依次增强,故C错误;
d?随着原子序数的增大,单质得电子能力逐渐减弱,所以单质F2、Cl2、Br2、I2中与氢气化合逐渐困难,故d错误;
故答案为:a;
(4)①从卤素单质的键能大小图可知,氯气分子中氯氯键的键能大于溴单质中溴溴键,而氯原子的得电子能力大于溴,所以非金属性强的卤素,其单质分子的化学键不一定容易断裂,
故答案为:不一定容易;
②同一主族,从上往下,半径在逐渐增大,所以原子半径I>Br>Cl>F,所以卤化氢的键长按H-F、H-Cl、H-Br、H-I的顺序依次增大,从卤素单质的键能大小图可知,除F2外.键长增大,而键能与键长成反比,所以依次减小,
故答案为:除F2外.键长增大,键能减小;
 ;反应③为氢原子和氯气反应,所以破坏的是氯气分子中的氯氯键,同一元素组成的双原子分子为非极性分子,所以破坏的是非极性共价键,
;反应③为氢原子和氯气反应,所以破坏的是氯气分子中的氯氯键,同一元素组成的双原子分子为非极性分子,所以破坏的是非极性共价键,故答案为:
 ;非极性;
;非极性;(2)短周期主族元素中与氯元素相邻的有F和S,根据同周期和同主族元素原子的半径变化规律同一周期,从左到右,原子序数增大,半径在逐渐减小,所以原子半径S>Cl,同一主族,从上往下,半径在逐渐增大,所以原子半径Cl>F,综上可知,三者的原子半径从大到小的顺序是S>Cl>F;与氯同周期,金属性最强的元素位于该周期的最左侧,为Na元素,钠为第三周期,第IA,
故答案为:S>Cl>F; 三;IA;
(3)a.卤化银的颜色按AgCl为白色固体、AgBr为浅黄色固体、AgI为黄色固体,所以它们的颜色依次加深,故a正确;
b?同一主族,从上往下,半径在逐渐增大,所以原子半径I>Br>Cl>F,所以卤化氢的键长按H-F、H-Cl、H-Br、H-I的顺序依次增大,故b错误;
c?随着原子序数的增大,单质得电子能力逐渐减弱,所以其阴离子失电子能力逐渐增强,所以HF、HCl、HBr、HI的还原性按HF、HCl、HBr、HI的顺序依次增强,故C错误;
d?随着原子序数的增大,单质得电子能力逐渐减弱,所以单质F2、Cl2、Br2、I2中与氢气化合逐渐困难,故d错误;
故答案为:a;
(4)①从卤素单质的键能大小图可知,氯气分子中氯氯键的键能大于溴单质中溴溴键,而氯原子的得电子能力大于溴,所以非金属性强的卤素,其单质分子的化学键不一定容易断裂,
故答案为:不一定容易;
②同一主族,从上往下,半径在逐渐增大,所以原子半径I>Br>Cl>F,所以卤化氢的键长按H-F、H-Cl、H-Br、H-I的顺序依次增大,从卤素单质的键能大小图可知,除F2外.键长增大,而键能与键长成反比,所以依次减小,
故答案为:除F2外.键长增大,键能减小;
点评:本题主要考查了卤族元素的递变规律,掌握元素的周期性变化规律是解答的关键,题目难度中等.

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
 (2009?上海)迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.下列叙述正确的是( )
(2009?上海)迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.下列叙述正确的是( )