摘要: 已知: CH3 (CH2 )2CH3 ( g )+O2 ( g ) =4CO2 ( g ) + 5 H2O ( l ),△H=-2878kJ·mol一1 (CH3)2CHCH3 ( g ) +O2 ( g ) =4CO2 ( g ) + 5 H2O ( l ),△H = -2869 kJ·mol一1 下列说法正确的是( ) A.正丁烷的燃烧热为一2878kJ·mol一1 B.正丁烷分子所具有的能量大于异丁烷分子 C.等量的异丁烷分子中碳氢键比正丁烷的多 D.异丁烷转化为正丁烷的过程是一个放热过程
网址:http://m.1010jiajiao.com/timu3_id_57462[举报]
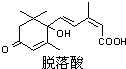 已知(CH3)2C=CH2可表示为
已知(CH3)2C=CH2可表示为 ,脱落酸属植物生长抑制剂,对该物质叙述正确的是( )
,脱落酸属植物生长抑制剂,对该物质叙述正确的是( )| A、分子式为C15H20O4 | B、属于芳香族化合物 | C、1mol该物质最多可与3mol H2发生反应 | D、在一定条件下发生反应生成含七元环的物质 |
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
⑴实验测得,1 g甲醇在氧气中充分燃烧生成二氧化碳和液态水释放出22.7kJ的热量,试写出甲醇燃烧的热化学方程式。
⑵由气态基态原子形成 1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
已知,CH3―CH3→CH2=CH2+H2;有关化学键的键能如下。
化学键 C-H C=C C-C H-H
键能(kJ/mol) 414.4 615.3 347.4 435.3
试计算该反应的反应热(在答题纸中写出计算过程)。
⑶依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行理论推算。
试依据下列热化学方程式,计算反应2C(s)+2H2(g)+O2(g) ![]() CH3COOH(l)的焓变(在答题纸中写出计算过程)。
CH3COOH(l)的焓变(在答题纸中写出计算过程)。
①CH3COOH(l)+2O2(g) ![]() 2CO2(g)+2H2O(l);△H1=-870.3kJ?mol-1
2CO2(g)+2H2O(l);△H1=-870.3kJ?mol-1
②C(s)+O2(g) ![]() CO2(g);△H2=-393.5kJ?mol-1
CO2(g);△H2=-393.5kJ?mol-1
③H2(g)+1/2O2(g) ![]() H2O(l);△H3=-285.8kJ?mol-1
H2O(l);△H3=-285.8kJ?mol-1
(2009?合肥二模)有机物A、B、C分子式均为C5H8O2,有关的转化关系如图所示,已知:A的碳链无支链,且1mol A 能与4mol Ag(NH3)2OH完全反应;B为五元环酯.
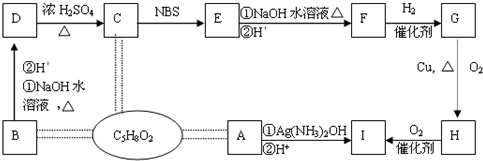
已知:CH3-CH=CH-R
CH2Br-CH=CH-R
请完成下列问题:
(1)写出I中所含官能团的结构简式
(2)B的结构简式为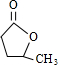
 .
.
(3)写出下列反应方程式(有机物用结构简式表示),并注明反应类型D→C
查看习题详情和答案>>

已知:CH3-CH=CH-R
| NBS |
请完成下列问题:
(1)写出I中所含官能团的结构简式
-COOH
-COOH
.G中所含官能团的名称羧基、羟基
羧基、羟基
.(2)B的结构简式为


(3)写出下列反应方程式(有机物用结构简式表示),并注明反应类型D→C
CH3CH(OH)CH2CH2COOH
CH3CH=CHCH2COOH+H2O
| 浓硫酸 |
| △ |
CH3CH(OH)CH2CH2COOH
CH3CH=CHCH2COOH+H2O
;(| 浓硫酸 |
| △ |
消去反应
消去反应
反应)E→F(只写①条件下的反应)BrCH2CH=CHCH2COOH+2NaOH
HOCH2CH=CHCH2COONa+NaBr+H2O
| 水 |
| △ |
BrCH2CH=CHCH2COOH+2NaOH
HOCH2CH=CHCH2COONa+NaBr+H2O
.(| 水 |
| △ |
取代反应
取代反应
反应)【化学选修3物质结构与性质】已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子.请回答下列问题:
(1)X元素原子基态时的电子排布式为 ,该元素的符号是 .
(2)Y元素原子的电子轨道表示式为 ,元素X与Y的电负性比较:X Y(填“>”或“<”).
(3)X与Z可形成化合物XZ3,该化合物的空间构型为 .
(4)由元素X与镓元素组成的化合物A为第三代半导体.
已知化合物A的晶胞结构如图所示.(黑球位于立方体内,白球位于立方体顶点和面心)

请写出化合物A的化学式 :化合物A可由(CH3)3Ga和AsH3在700℃下反应制得,反应的化学方程式为
(5)已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式为 .
查看习题详情和答案>>
(1)X元素原子基态时的电子排布式为
(2)Y元素原子的电子轨道表示式为
(3)X与Z可形成化合物XZ3,该化合物的空间构型为
(4)由元素X与镓元素组成的化合物A为第三代半导体.
已知化合物A的晶胞结构如图所示.(黑球位于立方体内,白球位于立方体顶点和面心)

请写出化合物A的化学式
(5)已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式为
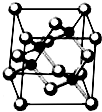 Ⅰ.砷化镓为第三代半导体,以其为材料制造的灯泡寿命长.耗能少.已知砷化镓的晶胞结构如图所示.请回答下列问题:
Ⅰ.砷化镓为第三代半导体,以其为材料制造的灯泡寿命长.耗能少.已知砷化镓的晶胞结构如图所示.请回答下列问题:(1)下列说法正确的是
A.砷化镓晶胞结构与NaCl相同 B.第一电离能 As>Ga C.电负性 As>Ga D.原子半径 As>Ga
(2)AsH3空间形状为
Ⅱ.金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业.
(3)Cu2+的核外电子排布式为
(4)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有