摘要: Al3+ + 3H2O Al(OH)3 +3 H+ 的平衡体系中.要使平衡向水解方向移动.且使溶液的pH值增大.应采取的措施是 A.加热 B.加适量NaOH溶液 C.通入氯化氢气体 D.加入固体三氯化铝
网址:http://m.1010jiajiao.com/timu3_id_57417[举报]
下列离子方程式错误的是( )
| A、向Mg(HCO3)2溶液中加入足量的澄清石灰水:Mg2++2HCO3-+2Ca2++4OH-?2CaCO3↓+Mg(OH)2↓+2H2O | B、明矾的水解:Al3++3H2O?Al(OH)3↓+3H+ | C、AgCl悬浊液中加入硫化钠饱和溶液:2AgCl+S2-?Ag2S+2Cl- | D、FeCl3溶液中加入硫氰化钾溶液:Fe3++6SCN-?Fe(SCN)6 |
 (2013?德州模拟)铁、铝及其化合物在生产和生活中有着广泛的应用.
(2013?德州模拟)铁、铝及其化合物在生产和生活中有着广泛的应用.(1)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护.在相同条件下,三组装置中铁电极腐蚀最快的是
①
①
(填装置序号),该装置中正极电极反应式为O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
;为防止金属Fe被腐蚀,可以采用上述②③
②③
(填装置序号)装置原理进行防护;装置③中总反应的离子方程式为2Cl-+2H2O
H2↑+Cl2↑+2OH-
| ||
2Cl-+2H2O
H2↑+Cl2↑+2OH-
.
| ||
(2)新型固体LiFePO4隔膜电池广泛应用于电动汽车.
电池反应为FePO4+Li
| 放电 |
| 充电 |
正
正
极移动(填“正”或“负”),负极反应为Li-e-=Li+,则正极反应式为FePO4+Li++e-=LiFePO4
FePO4+Li++e-=LiFePO4
.(3)广西治理龙江河镉(Cd2+)污染时,先向河中投入沉淀剂将Cd2+转化为难溶物,再投入氯化铝,试说明氯化铝的作用
氯化铝溶于水,Al3+发生水解:Al3++3H2O?Al(OH)3+3H+,生成Al(OH)3胶体,能吸附镉的难溶物而发生聚沉(或沉降、沉淀或沉积下来),从而消除Cd2+污染
氯化铝溶于水,Al3+发生水解:Al3++3H2O?Al(OH)3+3H+,生成Al(OH)3胶体,能吸附镉的难溶物而发生聚沉(或沉降、沉淀或沉积下来),从而消除Cd2+污染
(用必要的离子方程式和文字进行解释).材料在人类生活、生产中发挥着重要的作用.
(1)钠、铝、铁是常见的金属.
①在三种金属元素中,所形成氧化物种类最多的是
②向盛有硫酸铝溶液的试管中滴加氨水,反应的离子方程式为
得到的胶状沉淀物在医疗上治疗胃酸过多,利用的原理用离子方程式表示为
③向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,剩余固体中有铜无铁,则溶液中一定存在的阳离子为
④生产中曾用铝热反应(铝与铁的氧化物反应生成氧化铝和铁)焊接钢轨,则铝与氧化铁发生反应的化学方程式为
(2)工业上,在电炉中用炭粉还原二氧化硅可制得硅和一氧化碳.若向电炉里加入适量炭粉和30g二氧化硅,通电后反应,生成的一氧化碳在标况下的体积为
查看习题详情和答案>>
(1)钠、铝、铁是常见的金属.
①在三种金属元素中,所形成氧化物种类最多的是
铁
铁
;三种元素形成的氧化物中属于碱性氧化物的有3
3
种.②向盛有硫酸铝溶液的试管中滴加氨水,反应的离子方程式为
Al3++3NH3.H2O=Al(OH)3↓+3NH4+
Al3++3NH3.H2O=Al(OH)3↓+3NH4+
,得到的胶状沉淀物在医疗上治疗胃酸过多,利用的原理用离子方程式表示为
Al(OH)3+3H+=Al3++3H2O
Al(OH)3+3H+=Al3++3H2O
.③向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,剩余固体中有铜无铁,则溶液中一定存在的阳离子为
Fe2+
Fe2+
,可能存在的阳离子为Cu2+
Cu2+
,一定不存在的阳离子为Fe3+
Fe3+
.④生产中曾用铝热反应(铝与铁的氧化物反应生成氧化铝和铁)焊接钢轨,则铝与氧化铁发生反应的化学方程式为
2Al+Fe2O3
Al2O3+2Fe
| ||
2Al+Fe2O3
Al2O3+2Fe
,要得到1mol金属铁,需要铝的质量
| ||
27
27
g.(2)工业上,在电炉中用炭粉还原二氧化硅可制得硅和一氧化碳.若向电炉里加入适量炭粉和30g二氧化硅,通电后反应,生成的一氧化碳在标况下的体积为
22.4L
22.4L
.(2012?顺义区二模)硫酸铝铵常用于水的净化以及工业水的处理.硫酸铝铵是白色透明结晶硬块,易溶于热水,水溶液呈酸性;随温度升高、脱去结晶水,产生晶变.工业用铝土矿(主要成分Al2O3、少量SiO2、Fe2O3、MgO等)为原料制取硫酸铝铵的工艺流程示意图如下:
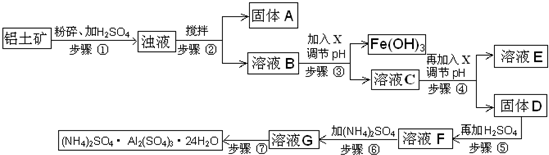
部分氢氧化物沉淀的pH如下表:
请回答下列问题:
(1)步骤③中调节pH使Fe(OH)3沉淀完全,检验Fe3+是否沉淀完全的操作是
(2)若X为NaOH,步骤④中发生反应的离子方程式是
(3)用化学平衡移动原理解释步骤⑤中加入硫酸的作用
(4)硫酸铝铵水溶液呈酸性的原因是
(5)步骤⑥中,要求温度控制在90-100℃之间至硫酸铵全部溶解,其原因是
(6)步骤⑦的操作方法包括
查看习题详情和答案>>

部分氢氧化物沉淀的pH如下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 3.8 | 2.7 | 9.4 |
| 完全沉淀pH | 5.2 | 3.2 | 12.4 |
(1)步骤③中调节pH使Fe(OH)3沉淀完全,检验Fe3+是否沉淀完全的操作是
取少量溶液C于试管中,加入2~3滴KSCN溶液,若溶液变成红色,说明Fe3+未沉淀完全;若溶液不变色,说明Fe3+已沉淀完全
取少量溶液C于试管中,加入2~3滴KSCN溶液,若溶液变成红色,说明Fe3+未沉淀完全;若溶液不变色,说明Fe3+已沉淀完全
.(2)若X为NaOH,步骤④中发生反应的离子方程式是
Al3+﹢3OH-=Al(OH)3↓
Al3+﹢3OH-=Al(OH)3↓
.(3)用化学平衡移动原理解释步骤⑤中加入硫酸的作用
硫酸电离出氢离子与氢氧化铝电离出氢氧根离子反应生成水,使Al(OH)3溶解平衡右移,至Al(OH)3溶解
硫酸电离出氢离子与氢氧化铝电离出氢氧根离子反应生成水,使Al(OH)3溶解平衡右移,至Al(OH)3溶解
.(4)硫酸铝铵水溶液呈酸性的原因是
Al3+﹢3H2O?Al (OH)3﹢3H+、NH4++H2O?NH3?H2O+H+
Al3+﹢3H2O?Al (OH)3﹢3H+、NH4++H2O?NH3?H2O+H+
(用离子方程式表示).浓度均为0.1mol/L硫酸铝和硫酸铝铵两种水溶液,c(Al3+) 较大的是硫酸铝铵
硫酸铝铵
(填“硫酸铝铵”或“硫酸铝”)溶液.(5)步骤⑥中,要求温度控制在90-100℃之间至硫酸铵全部溶解,其原因是
因为硫酸铝铵易溶于热水,有利于生成;随温度升高、脱去结晶水,产生晶变.所以
温度控制在90-100℃之间
温度控制在90-100℃之间
因为硫酸铝铵易溶于热水,有利于生成;随温度升高、脱去结晶水,产生晶变.所以
温度控制在90-100℃之间
.温度控制在90-100℃之间
(6)步骤⑦的操作方法包括
冷却,结晶、过滤、洗涤、干燥
冷却,结晶、过滤、洗涤、干燥
.欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去.已知:
(1)某含铬废水处理的主要流程如图所示: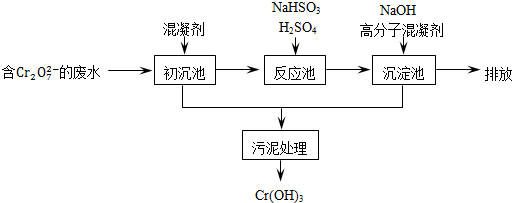
①初沉池中加入的混凝剂是K2SO4﹒Al2(SO4)3﹒24H2O,用离子方程式表示其反应原理是
②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+═2Cr3++3SO42-+4H2O.根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是
(2)工业可用电解法来处理含 Cr2O72-废水.实验室利用如图模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-═H2↑.Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是
查看习题详情和答案>>
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cr3+ | 6.0 | 8.0 |

①初沉池中加入的混凝剂是K2SO4﹒Al2(SO4)3﹒24H2O,用离子方程式表示其反应原理是
Al3++3H2O?Al(OH)3+3H+
Al3++3H2O?Al(OH)3+3H+
.②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+═2Cr3++3SO42-+4H2O.根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是
Cr3++3OH-═Cr(OH)3↓、H++OH-═H2O
Cr3++3OH-═Cr(OH)3↓、H++OH-═H2O
.证明Cr3+沉淀完全的方法是测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全
测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全
.
(2)工业可用电解法来处理含 Cr2O72-废水.实验室利用如图模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-═H2↑.Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是阴极反应消耗了水中的H+,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强
阴极反应消耗了水中的H+,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强
.用电解法处理该溶液中0.01mol Cr2O72-时,至少得到沉淀的质量是8.48
8.48
g.